
|
|||
|---|---|---|---|
|
|
Suplementación oral de creatina y rendimiento deportivo |
|
|
|
*Departamento de Educación Física y Deportiva. Facultad de Ciencias de la Actividad Física y del Deporte. Universidad de Granada. **Departamento de Fisiología. Profesor Titular de Fisiología del Ejercicio. Facultad de Ciencias de la Actividad Física y del Deporte. Universidad de Granada. ***Catedrático de Fisiología Médica. Facultad de Medicina. Universidad de Granada. (España) |
José Luis Mesa Mesa* Ángel Gutiérrez Sáinz** Manuel Joaquín Castillo Garzón*** chamaco@supercable.es |
|
|
|
|
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 7 - N° 36 - Mayo de 2001 |
|
|
1 / 2
Introducción
En las células con vida existen, con el fin de mantenerla, sistemas que producen energía (rutas catabólicas) y sistemas que consumen dicha energía (rutas anabólicas), siendo el vínculo esencial entre las vías de producción y de utilización de energía el nucleósido adenosina 5’-trifosfato (ATP), aunque existen diversos trifosfatos, como el nucleótido de guanina trifosfato (GTP, actúa como fuente de energía en el proceso de la gluconeogénesis y en la síntesis de proteínas), el nucleótido de uracilo trifosfato (UTP, se utiliza en la síntesis de glucógeno) y el citosín trifosfato (CTP, se utiliza en la síntesis de lípidos) relacionados con la transferencia de energía en procesos biosintéticos. Es por ello por lo que el ATP es considerado como la moneda de intercambio de energía en las células vivas, estando conformado por un nucleótido de adenina unido al carbono 2 de la D-ribosa por un enlace glucosídico.
En la posición 5 de la D-ribosa están esterificados tres grupos fosforilo en forma de lo que se denominan enlaces fosfoanhídrido; los dos grupos fosfato terminales (ß,
), que están implicados en la unión anhídrido del ácido fosfórico, se denominan enlaces ricos en energía o de alta energía, ya que la ruptura por hidrólisis o transferencia del enlace produce un cambio de energía (
Gº’ a pH 7.0) de -31.8 kJ/mol de ATP, siendo la reacción exergónica y liberando energía (31.8 kJ por cada mol de ATP hidrolizado) que en los miocitos o células musculares se utilizará en los procesos desencadenantes de la contracción muscular. Tal hidrólisis de un mol de ATP produce, en presencia de un mol de agua y un átomo gramo de Mg++, un mol de adenosina 5’-difosfato (ADP), un átomo gramo de fosfato inorgánico (Pi), otro de hidrogenión (H+) y los ya mencionados 31.8 kJ, por lo que el pool de ATP presente en las células musculares descendería progresivamente hasta su agotamiento durante el ejercicio si no fuera por los siguientes buffers del descenso de ATP intramuscular:
Durante ejercicios leves y moderados, la reacción catalizada por la gliceraldehído 3-fosfato deshidrogenasa [en la que el gliceraldehído 3-fosfato en presencia de nicotinamida adenina dinucleótido oxidado (NAD+) y Pi es oxidado a 1,3-bisfosfo-D-glicerato, produciendo además nicotinamida adenina dinucleótido reducido (NADH) y H+] necesita del coenzima NAD+ para su funcionamiento, obteniéndose éste de la reoxidación del NADH generado en la misma reacción mediante el sistema de lanzadera del glicerol fosfato. Es una vía aerobia que se lleva a cabo mediante la oxidación de carbohidratos, lípidos y proteínas, con los productos finales de CO2 y agua.
En el ejercicio que, debido a su elevada intensidad, desborde la capacidad de reoxidación del NADH generado por la gliceraldehído 3-fosfato deshidrogenasa mediante la lanzadera del glicerol fosfato y la concentración citosólica de NAD+ comience a disminuir, se hace necesario otro mecanismo para mantener constantes los niveles citosólicos de NAD+ (necesario para que pueda continuar la glucólisis). Tal rol lo asume la enzima lactato deshidrogenasa, que cataliza la reacción irreversible piruvato + NADH + H+ <-> L-lactato + NAD+, obteniéndose gracias a esta reacción el NAD+ necesario para que continúe la glucólisis, en este caso, anaerobia y produciéndose 2 ATP o, si se degrada glucógeno (glucogenólisis), 3 ATP por cada molécula de glucosa 6-fosfato que entra en la glucólisis.
En el ejercicio de muy alta intensidad y de muy corta duración (5-10”), la mayor parte de la producción de ATP requerida para la contracción muscular proviene del metabolismo anaerobio aláctico, esto es, mediante la contribución de dos enzimas, la creatina fosfoquinasa (CPK) y la adenilato quinasa (AK). La CPK cataliza la transferencia del grupo fosfato desde la fosfocreatina (PCr) hasta el ADP de modo energéticamente favorable para formar ATP y creatina (Cr), por lo que es una primera barrera para mantener constante la [ATP] intramiocitaria. El segundo tampón lo conforma la AK, que cataliza la reacción 2 ADP <-> ATP + AMP.
En las aves y mamíferos existen cuatro isoenzimas de la CPK: 1) la citosólica de tipo muscular (M-CPK), 2) la citosólica de tipo cerebral (B-CPK), 3) la sarcomérica mitocondrial (SMi-CPK) y 4) la ubiquitín-mitocondrial (UMi-CPK), estas dos últimas situadas en el espacio intermembrana de la mitocondria. Todos los isoenzimas de la CPK catalizan la transferencia reversible del grupo
fosfato del ATP al grupo guanidino de la Cr, produciendo ADP y un hidrogenión: Cr + ATP- PCr + ADP + H+ (ver figura 1).
Figura 1. Reacción catalizada por la CPK 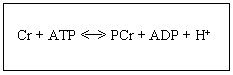
Debido a que durante el ejercicio la [ADP] intramuscular aumenta, el pH disminuye, a que la [PCr] es elevada [del orden de 15-25 mM (Kushmerick et al., 1992)] y a que
Gº’ a pH 7.0 para la hidrólisis de la PCr es de -45.0 kJ/mol, el equilibrio de la reacción tiende a desplazarse hacia la izquierda, produciendo ATP y Cr. Los mayores niveles de Cr y PCr se encuentran en el músculo esquelético (Kushmerick et al., 1992), corazón (Christensen et al., 1994), espermatozoides (Wallimann et al., 1986a) y células fotorreceptoras de la retina (Wallimann et al., 1986b). Niveles intermedios son encontrados en el cerebro, tejido adiposo marrón (Berlet et al., 1976), intestino, vesículas seminales (Lee et al., 1988), células endoteliales (Loike et al., 1992) y macrófagos (Loike et al., 1986), mientras que los niveles más bajos se encuentran en los pulmones, hígado, riñones, bazo, tejido adiposo blanco y células sanguíneas (Wyss & Kaddurah-Daouk, 2000).
La concentración normal de total Cr (Cr + PCr) es de unos 125 mmol/kg músculo seco (Balsom et al., 1994), estando el 65% fosforilada en forma de fosfocreatina en reposo (Connet, 1987; Casey et al., 1996a). A partir de 1920, la suplementación oral de Cr fue reconocida como un método eficaz para elevar la [total Cr] intramuscular (Hoberman et al., 1948; Crim et al., 1976) lo que da pie a las siguientes teorías que podrían explicar el posible efecto ergogénico de la suplementación oral de creatina: 1) una mayor [PCr] proporciona más ATP para la contracción muscular en ejercicios de corta duración y elevada intensidad, 2) una mayor [PCr], junto con ADP y H+ produciría ATP y Cr durante el esfuerzo, lo que amortiguaría parte de la bajada del pH y 3) el incremento del transporte de energía dentro de la célula producido por la Cr podría mejorar la performance en esfuerzos aerobios e intermitentes de alta intensidad.
Mayor [PCr] intramuscular optimiza el ejercicio intenso de corta duración
La [PCr] intramuscular en reposo varía con la edad, siendo de 39.5 mmol/kg músculo húmedo en jóvenes (30+5 años) y 35.0 mmol/kg músculo húmedo en sujetos de mediana edad (58+4 años) en el músculo cuádriceps (Smith et al., 1998a). Es lógico pensar que el aporte exógeno de creatina junto con una adecuada concentración de ATP, producirá, mediante la catálisis de la CPK, ADP, PCr y H+, con lo que se aumenta la [PCr] intramuscular y se ve más eficazmente tamponado el descenso de la [ATP] intramuscular durante el ejercicio intenso de corta duración, con lo que éste se vería optimizado. Esta teoría está actualmente aceptada y ha sido asociada con el éxito de los velocistas y vallistas ingleses a comienzos de los 90 (Williams & Branch, 1998).
La ingesta de monohidrato de creatina a razón de 25-30 g/día durante 5-6 días, aumenta las concentraciones intramusculares de PCr y Cr (Cr total) un 16%, pasando de 150 mmol/kg músculo seco hasta 175 mmol/kg músculo seco, siendo un 30% de tal incremento en forma de fosfocreatina (Harris et al., 1992) y manteniendo constante la [ATP] intramuscular en reposo (Snow et al., 1998; Vandenberghe et al., 1999; Rico, 2000), debido probablemente a que la Cr mitocondrial junto con el ATP produce, mediante la CPK mitocondrial, ADP, PCr y H+ en el espacio intermembrana, pasando el ADP producido a la matriz mitocondrial donde es fosforilado a ATP (Wyss & Kaddurah-Daouk, 2000).
Actualmente se acepta que la suplementación oral de creatina expande los depósitos intramusculares de Cr total por un 20% en humanos (Balsom et al., 1995; Febbraio et al., 1995; Casey et al., 1996b; Green et al., 1996a; Hultman et al., 1996; Volek et al., 1999). Tal incremento de la Cr total intramuscular es mayor en sujetos de mediana edad (58+4 años) que en jóvenes (30+5 años) (Smith et al., 1998a), debido a que los mayores incrementos de la Cr total intramuscular se observan en sujetos con bajas concentraciones iniciales de ésta (Harris et al., 1992; Greenhaff et al., 1994), y origina un aumento de la excreción urinaria de creatinina (Crn) (Hultman et al., 1996). El hecho de que los sujetos con bajas concentraciones de Cr son los más beneficiados se ve desacreditado por el hecho de que los sujetos que consumen carne en su dieta (23+7 µM de Cr plasmática) obtienen un 5% de mejora en el pico máximo de potencia en un test anaeróbico de Wingate modificado (3x20”) tras una semana de suplementación oral de Cr frente a sujetos vegetarianos (11+2 µM de Cr plasmática) tras el mismo tratamiento (Shomrat et al., 2000).
La suplementación oral de creatina aumenta la concentración de Cr total aunque no se realice ejercicio, aunque si la ingesta se ve acompañada de éste, el incremento es sustancialmente mayor (Harris et al., 1992), lo que se ve a su vez optimizado junto con la ingesta de glucosa (Green et al., 1996b) o glucosa, taurina y electrolitos, lo que mejora una repetición máxima en press de banca, el salto vertical y el tiempo en 100 yardas de forma significativa con respecto al consumo de Cr exclusivamente (Stout et al., 1999), debido a que se eleva la insulina plasmática a más de 100mUI/l dentro de los 20’ tras la ingesta de Cr y carbohidratos, lo que incrementa la actividad de la bomba ATPasa Na+-K+ y, por tanto, la resíntesis de Cr en las fibras musculares humanas (Steenge et al., 1998). La ingesta de Cr durante una semana incrementa la velocidad en 1.4% (P<0.05 vs grupo placebo), debido a que se incrementa la frecuencia de zancada en 1.5% (P<0.01 vs grupo placebo), de lo que se deduce que la ingesta oral de Cr acorta el tiempo de relajación muscular en ejercicios dinámicos (Van Leemputte, 1999; Vandenberghe, 1999; Schedel et al., 2000), debido probablemente a la facilitación de la actividad de la Ca++ ATPasa del retículo sarcoplásmico en miocitos suplementados con Cr (Pulido et al., 1998; Duke & Steele, 1999). En cuanto a los efectos positivos de la suplementación oral de Cr sobre la performance en ejercicios de alta intensidad no se han descrito diferencias entre sexos (Tarnopolsky & MacLennan, 2000).
La capacidad máxima para realizar trabajo mecánico (tanto total como pico máximo) depende directamente del incremento de la concentración de creatina total (r=0.71, P<0.05) (Casey et al., 1996b) (ver figura 2).
A pesar de que existen estudios que no muestran ningún efecto ergogénico de la suplementación oral de Cr sobre el ejercicio de alta intensidad, como el de Gilliam et al. (2000), en el que el aporte en 11 sujetos varones activos de [4 x (5g Cr + 1g glucosa)]/día no muestra diferencias estadísticamente significativas con respecto a un grupo placebo en el pico de momento de fuerza isocinético en 5x30 contracciones máximas voluntarias del cuádriceps en el dinamómetro Cybex II a 180º/s, el de Deutekom et al (2000), en el que, a pesar del aumento de masa corporal en 23 remeros tras la ingesta de 20g/día de Cr durante 6 días, no se mejoró la potencia pico ni el tiempo en el que se consigue ésta en 2x30” all out en cicloergómetro, o el de Jakobi et al. (2000), en el que el aporte de [4 x (5g Cr + 5g maltodextrina)]/día durante 5 días en 14 sujetos varones de 19 a 28 años no muestra diferencias estadísticamente significativas en la fuerza isométrica del codo en flexión ni en la activación muscular con respecto al grupo control, conclusiones debidas a errores metodológicos como un excesivo error ß en el tratamiento estadístico o la ausencia de la combinación del ejercicio físico de los grupos musculares que se emplean en el pretest y postest y la ingesta de Cr, es un acaecimiento ampliamente aceptado el efecto ergogénico que la suplementación oral de Cr produce sobre la performance del ejercicio de alta intensidad (Benzi, 2000; Francaux et al., 2000; Tarnopolsky & MacLennan, 2000; Casey & Greenhaff, 2000; Wyss & Kaddurah-Daouk, 2000).
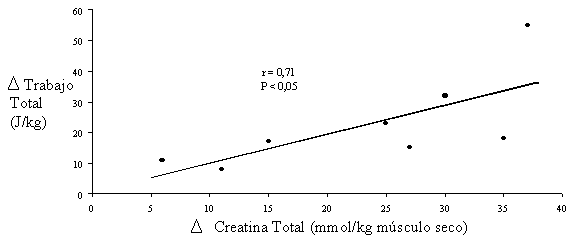
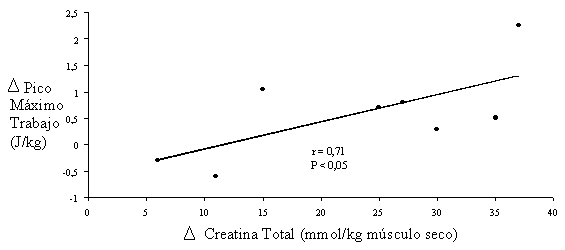
Figura 2. Dependencia entre el incremento de Cr total y la capacidad de realizar trabajo.
Adaptado de Casey et al., 1996b.
Ingesta de creatina y tamponamiento del descenso del PH intracelular
Debido a que la M-CPK utiliza un catión hidrogenión (H+), ADP y PCr para producir ATP y Cr en el interior de la fibra muscular, es lógico pensar que la suplementación oral de Cr pueda tener un efecto amortiguador sobre el descenso del pH intramiocitario en esfuerzos intensos, debido a: 1) una mayor [PCr] intramiocitaria atenúa la caída de la [ATP] intramiocitaria, con la que la glucogenólisis se retrasa, tamponándose la caída del pH y 2) teniendo en cuenta que la glucogenólisis se inicia prácticamente al comienzo del ejercicio intenso, mayor [PCr] intramiocitaria disminuiría la [H+] para producir ATP.
Tal hipótesis se ve ratificada por un reciente estudio de Rico Sanz (2000), en el que la ingesta de Cr a razón de 5g/día durante 11 días en 8 sujetos varones entrenados produce un mayor pH intramiocitario tras repetidas contracciones isométricas en flexión plantar al 32+1% de la máxima contracción voluntaria con respecto al pretest. Roussel et al. (2000) también corroboran lo expuesto, ya que hallan una dependencia lineal altamente significativa entre la resíntesis de PCr, el consumo de PCr y el pH al final del ejercicio (r=0.61, P=0.0007). La suplementación oral de Cr a razón de 20g/día durante 5 días incrementa la performance en un test de saltos continuos durante los primeros 15” en un 7% y en un 12% durante los segundos 15” (Bosco et al., 1997). Similarmente, el tiempo hasta la extenuación de la pierna al 80, 60, 40 y 20% de la máxima contracción voluntaria fue incrementado significativamente en sujetos entrenados en resistencia tras la ingesta de 10g/día durante 5 días de Cr (Maganaris & Maughan, 1998).
En kayakistas de elite, la suplementación de Cr (20g/día durante 5 días) aumenta significativamente el trabajo ejecutado en 3 tests máximos en kayak-ergómetro de 90, 150 y 300” de duración por 7-16% (McNaughton et al., 1998). Todo lo anterior, junto con el hecho de que el lactato muscular inducido por el ejercicio desciende tras la ingesta de Cr (Balsom et al., 1995; Juhn & Tarnopolsky, 1998), reafirman la hipótesis de que la ingesta de Cr retrasa la glucogenólisis y amortigua el descenso del pH ante una misma carga de ejercicio físico, predominantemente anaerobio.
Creatina y mejora del transporte de energía intracelular
El corazón, las fibras musculares lentas o los espermatozoos, necesitan de una más continua y duradera entrega de fosfatos de alta energía a los sitios de utilización de ATP. De acuerdo con la hipótesis de la lanzadera para el sistema CPK, distintas isoenzimas CPK están asociadas con sitios de producción de ATP (Mi-CPK en el espacio intermembrana mitocondrial) y consumo de ATP (M-CPK) y cumplir así el transporte de fosfatos de alta energía.
El grupo
fosfato del ATP sintetizado en la matriz mitocondrial es transferido por la Mi-CPK en el espacio intermembrana a la Cr, produciendo PCr y ADP. El ADP liberado por la Mi-CPK puede ser directamente transportado de vuelta a la matriz mitocondrial, donde es refosforilado a ATP. La PCr deja la mitocondria y difunde a través del citosol a los sitios donde se consume ATP (sarcolema, retículo sarcoplásmico y línea M miofibrilar) fundamentalmente las isoenzimas CPK citosólicas transfieren el fosfato de la PCr al ADP, generando ATP y garantizando así un alto potencial de fosforilación en las respectivas ATPasas. La Cr liberada de estas reacciones vuelve a la mitocondria, cerrándose el ciclo. Según esta hipótesis, el transporte de fosfatos de alta energía desde los sitios de producción de ATP a los de consumo de ATP está mantenido principalmente por PCr y Cr.
| Lecturas: Educación Física y Deportes · http://www.efdeportes.com · Año 7 · Nº 36 | sigue Ü |