
|
|||
|---|---|---|---|
|
|
Metabolismo protéico no músculo esquelético de ratos submetidos a exercício em intensidade equivalente ao limiar anaeróbio |
|
|
|
Departamento de Educação Física Laboratório de Biodinâmica Universidade Estadual Paulista (UNESP) Campus Rio Claro-SP (Brasil) |
Priscila Breseghelo Camargo Fabrício Azevedo Voltarelli Camila Aparecida Machado de Oliveira Maurício Ferreira Paiva Claudio Alexandre Gobatto Maria Alice Rostom de Mello faunesp8@yahoo.com.br | mellomar@rc.unesp.br |
|
|
|
|
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 10 - N° 93 - Febrero de 2006 |
|
|
1 / 1
Introdução
Entre os vários nutrientes existentes nos alimentos que ingerimos, os carboidratos e as gorduras são as principais fontes de energia para a realização da atividade física. Contudo, a utilização de proteína como fonte energética também ocorre, especialmente durante a realização de exercício de longa duração (CERSOSIMO, 1987).
O treinamento físico promove aumento do consumo máximo de oxigênio, facilitando a utilização dos ácidos graxos livres como fonte de energia muscular durante a realização de certos tipos de atividade física (COGGAN et al, 2000).
O suprimento adequado de oxigênio para a musculatura ativa durante o exercício físico é de importância fundamental , pois a oxidação de ácidos graxos livres depende do oxigênio como "receptor" de hidrogênio. Portanto, suprimento insuficiente de oxigênio restringe o combustível utilizável aos carboidratos, cujas reservas são limitadas. Além disso, a metabolização anaeróbia da glicose produz quantidade de energia 12 vezes inferior à sua metabolização aeróbia (McCARDLE et al, 1992).
Quando o suprimento de oxigênio é insuficiente, a metabolização da glicose processa-se somente até a formação de lactato. O aumento do lactato pode inibir a oxidação dos ácidos graxos livres, limitando a utilização desse substrato pelas células musculares (VAN LOON et al, 2001). Portanto, quanto maior a captação de oxigênio pelo tecido muscular, maior será a contribuição da gordura para o metabolismo energético.
Sabe-se que o exercício físico promove mudanças importantes no metabolismo dos aminoácidos. Essas mudanças podem resultar em respostas anabólicas ou catabólicas, dependendo de inúmeros fatores. Dois fatores importantes são a nutrição, especialmente o tipo e a quantidade da dieta consumida, e o exercício físico, especialmente quanto à intensidade, duração e freqüência (LEMON, 1997).
A literatura recente sugere que as necessidades de proteína e/ou aminoácidos possam estar aumentadas em indivíduos sujeitos a treinamento físico, quer participando de atividades de alta intensidade e curta duração, quer participando de atividade de moderada e alta intensidade e longa duração. Contudo, este ponto de vista ainda é discutível (LEMON, 1997). Assim sendo, é de grande interesse o estudo dos efeitos do treinamento físico e da intensidade do exercício sobre o metabolismo protéico muscular.
Uma vez que existem limitações óbvias nas pesquisas com seres humanos, modelos experimentais oferecem a possibilidade de estudos aos níveis celular e molecular das adaptações metabólicas ao exercício. Por outro lado, muitos resultados provenientes de pesquisas com animais são passíveis de críticas pois, na maioria das vezes, faltam informações sobre a intensidade do esforço realizado pelo animal durante o exercício. Dessa forma, os efeitos do exercício em intensidade conhecida sobre o metabolismo muscular de proteínas em modelo animal podem ser de grande valia
Objetivo geralO presente estudo foi delineado para analisar os efeitos do treinamento físico realizado em intensidade equivalente ao Limiar Anaeróbio (Lan) sobre o metabolismo protéico muscular em modelo experimental, usando ratos.
Objetivos específicosAnalisar no músculo sóleo isolado, proveniente de ratos sedentários e treinados por exercício de natação em intensidade equivalente ao Lan:
Concentração de proteína total
Concentração de DNA
Síntese de proteínas
Degradação de proteínas
Revisão de literatura1. Proteína e exercício
O exercício promove alterações importantes no metabolismo protéico, que podem resultar em respostas anabólicas ou catabólicas, na dependência não só da intensidade, duração e freqüência do exercício como também da ingestão alimentar, especialmente quantidade e qualidade da dieta consumida (LEMON, 1991; 1997; 1998).
Existem evidências de que o exercício de longa duração ocasiona aumento no consumo de diversos aminoácidos como fonte energética (HARALAMBIE; BERG, 1976; LEMON; MULIN, 1980; BROOKS, 1987), especialmente os de cadeia ramificada (WHITE; BROOKS, 1988; LEMON et al.,1982). Acredita-se que o exercício de resistência aeróbia promova este tipo de resposta de catabolismo protéico principalmente se a ingestão de aminoácidos e energia for inadequada (DOHM et al., 1977).
Embora treinamento de força possa ser extremamente intenso, as sessões são rápidas, tornando pouco provável que a oxidação de aminoácidos tenha papel relevante no suprimento de energia nesse tipo de exercício. Os carboidratos são os principais combustíveis. Na verdade, exercício de curta duração e alta intensidade promove anabolismo protéico, elicitando várias reações bioquímicas essenciais à hipertrofia do músculo (KRAEMER et al., 1996). Estudos com músculos isolados demonstraram que a taxa de transporte de aminoácidos é proporcional à atividade contrátil (GOLDBERG et al., 1975). Experimentos conduzidos em diafragmas de ratos mostraram que o músculo estimulado eletricamente na porção hemilateral, mantendo-se a porção contralateral inativa, sugerem que o número total de contrações é proporcional ao transporte de aminoácidos (GOLDBERG et al., 1975). Contrações repetidas diminuem o catabolismo protéico em músculo incubado. Além disso, a tensão passiva, por si só, reduz a degradação protéica, o que pode estar relacionado à sensibilidade às proteases ou à maquinaria proteolítica como um todo (GOLDSPINK, 1992; GOLDSPINK et al., 1995; MIDAOUI et al., 1996).
De acordo com estudos realizados utilizando técnica de balanço nitrogenado, a ingestão protéica de atletas de força é, geralmente, superior às necessidades (CELEJOWA; HOMA, 1970; TARNOPOLSKY et al., 1988). Por outro lado, existem evidências de que embora seja possível manter balanço nitrogenado positivo com ingestão protéica igual ou ligeiramente acima do consumo diário recomendado (CONSOLAZIO et al., 1975; TORUN et al., 1977; MARABLE, 1979), ingestão maior seria necessária para gerar aumento ideal do volume e força musculares (WALBERG et al., 1988; LEMON et al., 1992; TARNOPOLSKY et al., 1992). Alguns autores consideram, porém, que as necessidades protéicas de indivíduos que se engajam em programas de exercício de força estejam aumentadas apenas durante o período de tempo no qual a maior parte da hipertrofia muscular está ocorrendo (LEMON, 1991; KRAEMER et al., 1996; LEMON, 1998). Segundo esses autores, as necessidades protéicas decaem em indivíduos bem condicionados, nos quais a redução na taxa de degradação protéica em algumas fibras por si só pode ser suficiente para manter o ganho hipertrófico (KRAEMER et al., 1996).
Uma vez que existem limitações óbvias nas pesquisas com seres humanos, modelos experimentais oferecem a possibilidade de estudos aos níveis celular e molecular das adaptações metabólicas ao exercício. Por outro lado, muitos resultados provenientes de pesquisas com animais são passíveis de críticas pois, na maioria das vezes, faltam informações sobre a intensidade do esforço realizado pelo animal durante o exercício. Dessa forma, os efeitos do exercício em intensidade conhecida sobre o metabolismo muscular de proteínas em modelo animal podem ser de grande valia
2. Limiar anaeróbio (Lan)Em seres humanos, a intensidade do exercício pode ser estimada através de um marcador sangüíneo, o lactato (SJODIN e JACOBS, 1981). A concentração sangüínea de repouso varia entre 0,7 e 1,0 mm e, durante o exercício, esse valor pode aumentar bastante, chegando a atingir valores até 20,0 a 25,0 mm. Alguns autores sugerem a ocorrência de um limiar aeróbio quando o lactato sangüíneo atinge a concentração de 2,0mm (KINDERMAN et al, 1979) e um limiar anaeróbio equivalente à máxima de esforço capaz de ser mantido pelo predomínio do energético do sistema aeróbio (MADER et al, 1986). O Lan é alcançado quando o valor de lactato sangüíneo atinge 4,0mm (HECK et al, 1985). O Lan tem sido apontado como bom preditor da capacidade aeróbia de atletas. Estudos apontaram elevada correlação entre a velocidade de corrida equivalente ao Lan e a velocidade de corrida na maratona (FARREL et al, 1979; STODIN e JACOBS, 1981). Constatou-se também, que a velocidade correspondente ao Lan poderia ser mantida durante 50 minutos ou mais de corrida (STEGGMAN e KINDERMAN, 1982). Foi relatado, ainda, que a maior eficiência para o treinamento em natação (MADER et al 1986), ciclo ergômetro (DENIS et al 1982) e esteira (PIERRE et al , 1990) ocorre na intensidade de exercício equivalente ao Lan.
Como existem limitações óbvias nas pesquisas realizadas com seres humanos, modelos animais, especialmente o rato, têm fornecido importantes informações quanto à respostas metabólicas ao exercício. Por essa razão, recentemente em nossos laboratórios foram desenvolvidos protocolos de testes específicos para a determinação do Lan em ratos (GOBATTO et al, 2001; VOLTARELLI et al, 2002), que podem ser muito úteis na adequada identificação da intensidade do esforço realizado pelos animais durante o exercício.
Material e métodos1. Animais
Foram utilizados ratos da linhagem Wistar jovens (60 dias no início do experimento) que tiveram livre acesso à água e ao alimento (ração comercial para roedores), durante todo o experimento.
2. Grupos experimentaisOs animais foram distribuídos aleatoriamente em dois grupos:
sedentários: mantidos inativos
treinados: submetidos a treinamento de natação na intensidade equivalente ao Lan
O estudo foi dividido em duas séries de experimentos:
1ª série: a avaliação das taxas de degradação e síntese protéicas, bem como os teores de proteína e DNA do músculo sóleo isolado, dos animais sacrificados em repouso.
2ª série: a avaliação das taxas de degradação e síntese protéicas, bem como os teores de proteína e DNA do músculo sóleo isolado, dos animais sacrificados imediatamente após o exercício agudo de natação
3. Adaptação ao meio líquidoOs ratos foram adaptados ao meio líquido por 3 semanas em tanques coletivos (100cmx80cmx80cm), contendo água rasa a 30 - 32ºC por 60 minutos diários. Nas 2º e 3º semanas de adaptação, os animais portaram sobrecarga de 5% do peso corporal, atada ao tórax. O objetivo dessa etapa foi reduzir o estresse frente ao exercício físico realizado na água.
4. Determinação do limiar anaeróbio (Lan) pelo teste de lactato mínimo adaptado ao ratoO Lan foi determinado pelo teste do lactato mínimo, conforme proposto para humanos (TEGTBUR et al, 1993; JONES &DOUST, 1998), modificado para ratos. Este teste envolve: a) um período breve de exercício de alta intensidade para provocar um aumento de lactato sangüíneo circulante; b) um período de breve recuperação para assegurar níveis altos de lactacemia e c) um protocolo de teste de exercício com cargas progressivas, com coleta de sangue para análise de lactato a cada carga. Uma vez que a porção progressiva do teste de lactato mínimo começa quando o sujeito apresenta níveis altos de lactato sangüíneo, o teste produz um perfil de lactato sangüíneo característico, em forma de "U". O lactato mínimo sangüíneo foi definido como a intensidade de exercício na qual a "curva em forma de U", derivada dos valores de lactato sangüíneo obtidos durante o teste de lactato mínimo, atinja o nadir (TEGBUR et al, 1993). Partindo deste conceito de lactato mínimo, foi realizado em nosso laboratório estudo para adaptar o teste às condições do rato (VOLTARELLI et al, 2002). O protocolo empregado, que será descrito a seguir, mostrou-se exeqüível e foi utilizado no presente estudo, com as condições que se fizeram necessárias.
Inicialmente, os animais foram colocados no tanque cheio d'água suportando sobrecarga de 50% do peso corporal e se exercitam anaerobiamente (saltos) durante 3 minutos (30 segundos de atividade interrompidos por 30 segundos de repouso), para a elevação da concentração de lactato sangüíneo circulante. Em seguida, foram coletadas amostras de sangue através de corte na extremidade da cauda do animal, para a determinação da concentração do substrato. Após 9 minutos de repouso, os animais iniciaram exercício (natação) com intensidades progressivamente maiores. A primeira carga equivaleu a 4,5% do peso corporal, sendo acrescida de 0,5% a cada 5 minutos, até a exaustão. A cada troca de carga, foi coletada amostra de sangue para dosagem de lactato.
Foi elaborado um gráfico de lactato sanguíneo vs carga, com curva de ajuste polinomial de grau 2, com auxílio de um programa de computador (EXCEL©), para determinação matemática (pela análise da função) do menor valor sangüíneo de lactato e respectiva carga de trabalho. Esse menor valor indicou o Lan.
5. Determinação do lactato sanguíneoTodas as amostras de sangue (25ml) foram coletadas a partir de corte na extremidade distal da cauda do animal com auxílio de um tubo capilar graduado e colocadas em tubos eppendorf de 1,5ml, contendo 50ml de fluoreto de sódio 1%. Para evitar a diluição do lactato sangüíneo pela água residual do corpo e da cauda do animal, estes últimos foram secos, com uma toalha, imediatamente antes da coleta de sangue. As concentrações de lactato foram determinadas em analisador eletroquímico de lactato (YSI modelo 1500 SPORT, Yellow Spring, OH, USA).
6. Treinamento físicoEsse procedimento teve início 48 horas após o teste de lactato mínimo. Para isso, os ratos foram submetidos por 6 semanas a exercício de natação em tanques coletivos (100cmx80cmx80cm) contendo água a 30 - 32º, 5 dias por semana, suportando carga equivalente ao Lan.
7. Metabolismo pretéico muscularApós 8 semanas, animais de ambos os grupos foram sacrificados por decapitação, na condição de repouso ou após exercício agudo de natação, para a avaliação das taxas de degradação (liberação de tirosina) e síntese (incorporação de 14C fenilalanina em proteína) protéicas, bem como os teores de proteína e DNA do músculo sóleo isolado.
7.1. Síntese de proteínaFatias longitudinais (70mg) musculares foram pré-incubadas por 30 minutos em meio RPMI-1640 (com glutamina e sem fenol vermelho e bicarbonato de sódio), suplementado com albumina sérica bovina desengordurada (BSA) [0,1%] e insulina [100m/ml], saturado com mistura gasosa (95% de O2 e 5% de CO2). Em seguida, as fatias foram transferidas para o novo meio RPMI com a mesma suplementação, contendo 14C fenilalanina [0,05m Ci/ml] e incubados por 2 horas. Ao final da incubação, as fatias musculares foram homogeneizadas em ácido tricloro acético (TCA) 5% e centrifugadas a 2000 rpm por 15 minutos a 4ºC. O material TCA-insolúvel foi lavado 3 vezes com TCA 5%. O precipitado resultante foi dissolvido em (SDS) 10% à temperatura ambiente por 30 minutos, para a determinação do conteúdo protéico e da radioatividade incorporada às proteínas musculares. O conteúdo de proteína muscular foi determinado pelo método folin fenol e a radioatividade incorporada à proteína muscular foi medida com o auxílio de um cintilador. A síntese protéica foi calculada dividindo-se a radioatividade incorporada pela radioatividade específica da fenilalanina no meio de incubação e expressa como nanomoles de fenilalanina incorporada por miligrama de proteína por 2 (duas) horas.
7.2. Degradação de proteínaA liberação de tirosina pelo músculo isolado na presença de ciclohexamida foi utilizada como índice de degradação protéica. Este método vale-se do fato de que o aminoácido tirosina não é sintetizado nem degradado pelo músculo esquelético. Fatias longitudinais musculares (70mg) foram pré-incubadas em tampão Kregs-Ringer [NaCl 1,2 mmol/L; KCl 4,8 mmol/L; NaHCO3 25 mmol/L; CaCl2 2,5 mmol/L; KH2PO4 1,2 mmol/L e MgSO4 1,2 mmol/L - ph 7,4] suplementado com glicose [5,5 mmol/L], BSA [1,34%], insulina [5m/ml] e ciclohexamida [5,0 mmol/L], saturado com mistura gasosa (95% de O2 e 5% de CO2). Em seguida, as fatias foram transferidas para novo meio de mesma composição e incubada por 2 (duas) horas. Ao final da incubação, amostras do meio de incubação foram utilizadas para a determinação do teor de tirosina.
7.3. Teores de proteína total e DNAForam efetuadas determinações dos teores de proteína total (LOWRY et al, 1951) e DNA (GILES e MEYER, 1965) do músculo sóleo, visando inferir sobre tamanho (razão proteína/DNA) e número (DNA) de células nesse músculo (WINICK et al, 1972).
8. EstatísticaOs resultados acham-se expressos como média + desvio padrão e foram analisados pelo teste t student. Em todos os casos, o nível de significância será pré-fixado em 5 %.
Resultados1ª Série de Experimentos
As figuras 1 e 2 mostram as curvas de lactato sangüíneo vs. carga de trabalho de um mesmo rato, obtidos durante os testes de lactato mínimo realizados antes e após o treinamento. As curvas foram obtidas por ajuste polinomial de grau 2. As equações que definiram as curvas permitiram o cálculo do menor valor de lactato sangüíneo e da respectiva carga de trabalho. O menor valor de lactato sangüíneo indicou a carga de trabalho equivalente ao Lan. A título de exemplo, o Lan individual do animal antes do treinamento foi obtido na carga 5,5% do peso corporal, na concentração de 4,94 mmol/L de lactato sangüíneo (Figura 1). Em relação ao Lan individual calculado para o mesmo animal após o treinamento, o mesmo ocorreu na carga de 5,6% do peso corporal à concentração sangüínea de lactato de 4,79 mmol/L (Figura 2)
As tabelas 1 e 2 contêm os valores médios para todos os animais referentes à carga de exercício (% do peso corporal) e concentração sangüínea de lactato mmol/L. A tabela 1 mostra dados obtidos antes do treinamento, enquanto que a tabela 2 mostra dados obtidos após o período de treinamento, tanto para o grupo treinado quanto para aquele mantido sedentário. Na intensidade de exercício equivalente ao Lan, os valores de lactato sanguíneo foram maiores enquanto que a carga de trabalho foi menor no grupo treinado quando comparado ao sedentário.
A tabela 3 mostra valores médios para síntese e degradação de proteínas pelo músculo sóleo dos animais pertencentes aos grupos treinado e sedentário, sacrificados em repouso. Não houve diferenças na síntese protéica entre os grupos. A degradação reduziu-se no grupo treinado.
A tabela 4 contém valores médios de proteína, DNA e razão proteína/DNA no músculo sóleo dos animais dos grupos treinado e sedentário, sacrificados em repouso. Não houve diferenças significativas entre os grupos.
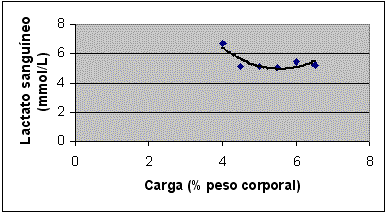
Figura 1. Curva de lactato sangüíneo vs. carga de trabalho de um rato da primeira série de experimentos durante o teste de lactato mínimo realizado antes do treinamento. A curva foi obtida por ajuste polinomial de grau 2, com auxílio de programa de computador (EXCEL®). A equação y = 0,5914x² - 6,5974x + 23,344, que define a curva, possibilitou o cálculo do menor valor da concentração de lactato sangüíneo (4,94 mmol/L) e respectiva carga de trabalho (5,5% do peso corporal). Esse menor valor de lactato sangüíneo indica a carga de trabalho equivalente ao Lan.
Figura 2. Curva de lactato sangüíneo vs. carga de trabalho de um rato treinado da primeira série de experimentos (o mesmo da Figura 3) durante o teste de lactato mínimo realizado após 8 semanas de treinamento. A curva foi obtida por ajuste polinomial de grau 2, com auxílio de programa de computador (EXCEL®). A equação y = 1,2x² - 13,471x + 42,59, que define a curva, possibilitou o cálculo do menor valor da concentração de lactato sangüíneo (4,79 mmol/L) e respectiva carga de trabalho (5,6% do peso corporal). Esse menor valor de lactato sangüíneo indica a carga de trabalho equivalente ao Lan. 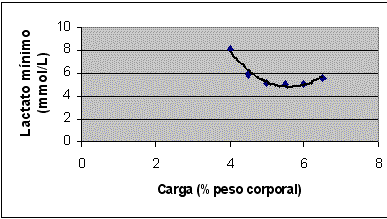
Tabela 1. Valores médios de lactato sangüíneo (mmol/L) e carga de trabalho equivalente ao Lan (% peso corporal) obtidos no teste de lactato mínimo realizado antes do treinamento físico (1º série de experimentos)

Tabela 2. Valores médios de lactato sangüíneo (mmol/L) e carga de trabalho (% peso corporal) dos ratos sedentários e treinados, obtidos no teste de lactato mínimo realizado após o treinamento (1º série de experimentos)

Resultados expressos como média + desvio padrão, com o número de animais entre parênteses.
* Diferença significativa (teste t, p<0,05) em relação ao grupo sedentárioTabela 3. Síntese (pmol/mg.h) e degradação (pmol/mg.h) de proteína no músculo sóleo de ratos treinados e sedentários, avaliados em repouso (1º série de experimentos)

Resultados expressos como média + desvio padrão de 8 fatias musculares por grupo
* Diferença significativa (teste t, p<0,05) em relação ao grupo sedentárioTabela 4. Teores de proteína (mmg/100mg), DNA (mg/100mg) e razão proteína/DNA no músculo sóleo de ratos treinados e sedentários, avaliados em repouso (1º fase de experimentos)

Resultados expressos como média + desvio padrão de 4 ratos por grupo
2ª Série de Experimentos
As figuras 3 e 4 mostram as curvas de lactato sangüíneo vs. carga de trabalho de um mesmo rato da segunda série de experimentos, durante os testes de lactato mínimo efetuados antes e após o treinamento. O Lan individual do animal antes do treinamento foi obtido na carga de 5,1% do peso corporal, na concentração sangüínea de 7,06 mmol/L de lactato (Figura 3). Em relação ao Lan individual calculado para o mesmo rato após o treinamento, o mesmo ocorreu na carga de 5,46% do peso corporal, à concentração de 5,16 mmol/L de lactato sangüíneo (Figura 4). Destaque-se a semelhança entre as curvas obtidas antes e após o treinamento físico com aquela obtida na primeira série de experimentos.
As tabelas 5 e 6 contém os valores médios para todos os animais referentes à carga de exercício (% do peso corporal) e concentração sangüínea de lactato (mmol/L). A tabela 5 contém os resultados obtidos antes do treinamento, enquanto que a tabela 6 mostra os resultados após o treinamento. Nota-se, mais uma vez, a semelhança com os resultados da primeira série de experimentos: valores de lactato sanguíneo maiores e de carga de trabalho menores na intensidade equivalente a o Lan para os ratos treinados quando comparados aos sedentários.
A tabela 7 mostra os valores médios para a síntese e degradação protéica pelo músculo sóleo isolado dos animais sacrificados imediatamente após o exercício agudo, enquanto que a tabela 8 contém os valores médios das concentrações de proteína e DNA bem como da razão proteína/DNA no mesmo músculo. Não houve diferença entre os grupos em nenhum desses parâmetros.
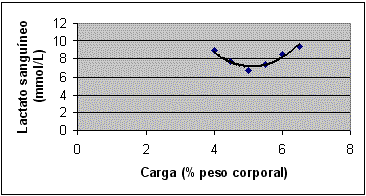
Figura 3. Curva de lactato sangüíneo vs. carga de trabalho de um rato da segunda série de experimentos durante o teste de lactato mínimo realizado antes do treinamento . A curva foi obtida por ajuste polinomial de grau 2, com auxílio de programa de computador (EXCEL®). A equação y = 1,3164x² - 13,508x + 41,769, que define a curva, possibilitou o cálculo do menor valor da concentração de lactato sangüíneo (7,06mmol/L) e respectiva carga de trabalho (5,1% do peso corporal). Esse menor valor de lactato sangüíneo indica a carga de trabalho equivalente ao Lan.
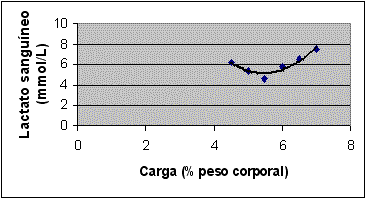
Figura 4. Curva de lactato sangüíneo vs. carga de trabalho de um rato treinado da segunda série de experimentos (o mesmo da Figura 3) durante o teste de lactato mínimo realizado após 8 semanas de treinamento. A curva foi obtida por ajuste polinomial de grau 2, com auxílio de programa de computador (EXCEL®). A equação y = 1,0736x² - 11,725x + 37,174, que define a curva, possibilitou o cálculo do menor valor da concentração de lactato sangüíneo (5,16mmol/L) e respectiva carga de trabalho (5,46% do peso corporal). Esse menor valor de lactato sangüíneo indica a carga de trabalho equivalente ao Lan.
Tabela 5. Valores médios de lactato sangüíneo (mmol/L) e carga de trabalho equivalente ao Lan (% peso corporal) obtidos no teste de lactato mínimo realizado antes do treinamento físico (2º série de experimentos)

Tabela 6. Valores médios de lactato sangüíneo (mmol/L) e carga de trabalho (% peso corporal) dos ratos sedentários e treinados, obtidos no teste de lactato mínimo realizado após o treinamento físico (2º série de experimentos)

Resultados expressos como média + desvio padrão, com o número de animais entre parênteses.
* Diferença significativa (teste t, p<0,05) em relação ao grupo sedentário
Tabela 7. Síntese (pmol/mg.h) e degradação (pmol/mg.h) de proteína no músculo sóleo de ratos sedentários e treinados por natação, submetidos ao exercício agudo de natação (2º série de experimentos)

Resultados expressos como média + desvio padrão de 10 fatias musculares por grupo
Tabela 8. Teores de proteína (mmg/100mg), DNA (mg/100mg) e razão proteína/DNA no músculo sóleo de ratos treinados e sedentários, avaliados após exercício agudo de natação (2º série de experimentos)

Resultados expressos como média + desvio padrão de 4 ratos por grupo
Discussão
Este estudo visou analisar os efeitos do exercício crônico e agudo realizado em intensidade equivalente ao limiar anaeróbio (Lan) sobre o metabolismo muscular de proteína em ratos.
Grande número de pesquisas envolvendo efeitos do exercício sobre o metabolismo têm sido conduzidas em animais de laboratórios, especialmente o rato, e as concentrações de lactato utilizada para a identificação da intensidade do esforço. Este é um ponto limitante nas pesquisas com modelos animais, pois ainda são raros os estudos que analisaram a cinética do lactato em ratos durante o exercício, especialmente durante a natação. Recentemente, nosso grupo de pesquisa (VOLTARELLI et al; 2002, 2004) padronizou um protocolo para a determinação do Lan em ratos durante exercício de natação baseado no teste de lactato mínimo (TLM) proposto para seres humanos por Tegtbur et al (1993).
No TLM originalmente descrito por Tegtbur el al (1993), a acidose lática inicial exigida pelo teste foi induzida em atletas por duas corridas exaustivas consecutivas. A segunda corrida foi seguida por 8 minutos de recuperação (andar lento). Em seguida, foi iniciado teste progressivo de corrida. No teste, adaptado para as condições do rato (VOLTARELLI et al; 2002, 2004), a acidose lática inicial foi obtida fazendo-se os animais saltarem dentro d'água suportando sobrecarga equivalente a 50% do peso corporal. Após 9 minutos de recuperação (repouso) foi iniciado teste de natação onde os animais suportavam cargas progressivamente maiores em relação ao peso corporal, até a exaustão. Nesse último estudo (VOLTARELLI et al; 2002), o Lan médio de animais sedentários foi estimado na carga de 4,95 ± 0,10 % do peso corporal, na concentração média de lactato sangüíneo de 7,17 ± 0,16 mmol/L. Esses resultados foram confirmados em outro estudo de nosso grupo (PRADA et al; 2004) onde o Lan médio de ratos sedentários determinados pelo TLM durante exercício de natação foi equivalente a 4,97 ± 0,22 % do peso corporal enquanto que a concentração sangüínea de média de lactato foi 7,28 ± 0,19 mmol/L.
Os valores calculados de intensidade de exercício e lactato sangüíneo correspondentes ao Lan de um rato avaliado no início do presente estudo (portanto na situação sedentária) são mostrados nas Figuras 1. Como pode ser notado, a carga de trabalho e a concentração de lactato sangüíneo equivalentes ao Lan para esse animal, mostram-se semelhantes aos valores obtidos nos estudos de Voltarelli el al (2002) e Prada et al (2004). Fato semelhante foi observado nos valores médios de todo o grupo.
Após determinado o Lan dos animais, procedeu-se ao treinamento dos mesmo nesta carga. Após 8 semanas de treinamento (Figura 2, referente à primeira série de experimentos), observou-se ligeiro aumento da carga de trabalho (5,6 % do peso corporal) e redução da concentração sangüínea de lactato (4,79 mmol/L) equivalente ao Lan individual do animal quando comparados aos valores observados na situação sedentária (Figura 1) bem como os valores encontrados por Voltarelli et al (2002) e Prada et al (2004) em ratos sedentários, indicando melhora no condicionamento aeróbio. Prada et al (2004) já haviam relatado anteriormente melhora do condicionamento aeróbio em ratos treinados por natação na carga equivalente ao Lan. A segunda série de experimentos reproduziu exatamente a mesma cinética de resultados, conforme pode ser notado nas figuras 3 e 4
Após o treinamento dos animais por natação na intensidade do Lan, procedeu-se à análise dos teores de proteína total e DNA no músculo sóleo, para inferir sobre os efeitos do referido treinamento sobre o tamanho e número de célula, respectivamente, nesse músculo. Não foram constatadas diferenças significativas nesses parâmetros entre os grupos em ambas as séries de experimentos do presente estudo.
O crescimento de qualquer órgão pode ser ocasionado por aumento no número de células (hiperplasia), por aumento no tamanho das células já existentes (hipertrofia) ou por ambos os processos concomitantemente. Segundo Winick et al (1972), o número total de células pode ser medido, com algumas exceções, determinando-se o conteúdo total de DNA e dividindo-se por uma constante que representa o conteúdo de DNA por núcleo diplóide na espécie em estudo.
Determinado o número de células, o peso médio por célula, o conteúdo protéico por célula, o conteúdo de RNA por célula, entre outros índices, podem ser avaliados, através de determinação da quantidade total de cada um desses elementos e dividindo-se pelo número de células, esse resultado pode ser expresso como razões peso/DNA, proteína/DNA, RNA/DNA, etc...
O aumento do conteúdo de DNA representa um tipo de crescimento, ou seja, o aumento do número de célula; enquanto que o aumento das razões proteína/DNA, peso/DNA e RNA/DNA reflitam outro aspecto do crescimento, ou seja, aumento da massa tecidual sem aumento no número de célula (WINICK et al; 1972).
Winick e Noble (1965) estudaram o crescimento de ratos a partir do 10º dia após a concepção até a idade adulta. Definiram 3 fases de crescimento para o animal como num fado. Na primeira, fase de hiperplasia, as células dividem-se continuamente e o tamanho permanece constante, uma vez que ocorreu aumentos equivalentes de DNA, peso e proteína. Na segunda, fase de hiperplasia e hipertrofia, a velocidade de divisão celular diminui e inicia-se aumento do tamanho da célula, ou seja, ocorre aumento lento do DNA e mais acelerado de peso, proteína e RNA, o que conduz ao aumento na razões peso/DNA, proteína/DNA e RNA/DNA. Na terceira e última, fase de hipertrofia, as células só aumentam de tamanho não mais se dividindo. Proteína, RNA e peso continuam aumentando, mas não o DNA, havendo aumento das razões peso/DNA, proteína/DNA e RNA/DNA.
Na maioria dos órgãos estudados, peso e proteína continuaram a aumentar até cerca de 100 dias de idade. Em contraste, DNA atingiu pico antes disso. No músculo esquelético, o DNA atingiu pico próximo aos 90 dias de idade (WINICK & NOBLE, 1965). No presente estudo, o treinamento dos animais deu-se entre os 60 e os 115 dias de idade e, teoricamente, poderia afetar tanto o crescimento muscular por hiperplasia quanto por hipertrofia. No entanto, isto não ocorreu em nosso estudo.
Para ampliar a análise dos efeitos do exercício crônico e agudo, realizados na intensidade do Lan sobre o metabolismo protéico muscular, foram avaliadas, "in vitro", as taxas de síntese e degradação protéicas no músculo sóleo. As fatias musculares incubadas mostraram balanço protéico negativo, mesmo na presença de insulina, como demonstrado previamente em estudos com fatias do músculo extensor digitorum longus (EDL) (SUDNBERG et al, 1999). Contudo, fatias incubadas de EDL foram consideradas pelos autores preparação sensível às alterações sofridas in vivo pelo metabolismo protéico.
As taxas de síntese e degradação protéica foram avaliadas no músculo sóleo isolado de ratos treinados e sedentários sacrificados tanto em repouso quanto imediatamente após uma sessão de exercício de natação realizado em intensidade equivalente ao Lan.
Na condição de repouso (primeira série de experimentos), a taxa de síntese protéica não se alterou ao passo que a taxa de degradação foi reduzida, quando comparados animais treinados com aqueles mantidos sedentários. Imediatamente após a realização de exercício de natação (segunda série de experimentos), essa diferença foi mascarada pelo efeito agudo do exercício.
A proteólise muscular envolve tanto vias lisossomais quanto não-lisossomais. A mais importante é a não lisossomal, que é controlada pelo sistema ubiquetina-proteossomo e envolve quebra de proteína metacelular e miofibrilar (KEE et al; 2002). Tal processo de degradação envolve múltiplos passos que são proteasomo-dependentes, incluindo a reubiquitiuização das proteínas (ATTAIX et al, 2001). Pode-se aceitar, de acordo com os resultados obtidos no presente estudo, a hipótese que essa via esteja menos ativada no músculo submetido ao treinamento físico. Estudos adicionais são necessários para a confirmação dessa hipótese, ou seja, torna-se muito importante a verificação dos efeitos do treinamento físico sobre a possível inibição (parcial) da via de degradação protéica ubiquetina-proteossomo.
Conclusões
-
Foi possível a determinação do limiar anaeróbio dos ratos pelo protocolo de teste empregado no presente estudo (teste do lactato mínimo);
-
O protocolo de teste mostrou-se sensível às alterações metabólicas induzidas pelo treinamento físico por natação, confirmando resultados de estudos anteriores;
-
O treinamento físico por natação na intensidade equivalente ao limiar anaeróbio melhorou o condicionamento aeróbio dos animais e provocou alterações no metabolismo protéico que podem ser benéficas ao crescimento muscular.
Agradecimentos
Os autores agradecem a Clarice Y. Sibuya, José Roberto R. da Silva e Eduardo Custódio pelo excelente suporte técnico e pela indispensável colaboração na coleta de dados. Agradecemos também às agências de fomento: Fapesp, Capes e CNPq.
Referências bibliográficas
-
ATTAIX D., COMBAREY L.; POUCH M. N.; TAILLANDER D. Regulation or proteolysis. Current Opinion in Clinical Nutrition and Metabolism Care, p. 45 - 49, 2001.
-
BROOKS, G. A. Aminoacid and protein catabolism during exercise and recovery. Med. Sci. Sports Exerc., 19: 150-156, 1987.
-
CELOJOWA, I., HOMA, M. Food intake, nitrogen and energy balance in polish weight lifters, during training camp. Nutr. Metab. , 12: 259-274, 1970.
-
CERSOSIMO, E. Fisiologia da nutrição. Rio de Janeiro. Cultura Médica, P. 37-45, 1985.
-
CONSOLAZIO, C. F., JOHNSON, H. L., NELSON, R. A., DRAMISE, J. G., SKALA,J. H. Protein metabolism during intensive physical training in the young adult. Am. J. Clin. Nutr. 28: 29-35, 1975.
-
COOGAN, A. R.; RAGUSO, C. A.; GASTALDELLI, A.; SIDOSSIS, L. S.; YECKEL, C. W. Fat metabolism during high-intensity exercise in endurance - trained and untrained men. Metabolism. 49 (1): 122 - 8, 2000.
-
DENIS, C. et al. Effect of 40 weeks of endurance training on anaerobic threshold. Int. J. Sports Med. 3: 208-214, 1982.
-
DOHM, G. L., HECKER, A. L., BROWN, W. E., KLAIN, G. J., PUENTE, F. R., ASKEW, E. W., BEECHER, G. Adaptation of metabolism protein to endurance training Increased aminoacids oxidation in response to training. Biochem. J., 164: 705-708, 1977.
-
FARREL, P. A. ET AL. Plasma lactate accumulation and distance running performance. Med. Sci. Sports. 11: 338-344, 1979.
-
GILES, K. W. E MAYERS, A. Na improved diphenylamine method for the estimation of Deoxybonucleic. Acid Nature. V. 206: I, n. 4975, p. 93,1965.
-
GOBATTO, et al. Maximal lactate steady state in rats submitted to swimming exercise. Comparative Biochemistry and Physiology (BCP), part a 130, 21-27, 2001.
-
GOLDBERG, A., ETLINGER, J. D., GOLDSPINK, D. F., JABLECK, C. Mechanism of work induced hypertrophy of skeletal muscle in trained rats. Med. Sci. Sports, 7: 248-261, 1975.
-
GOLDSPINK, C. Cellular and molecular aspects of adaptations in skeletal muscle. P. KOMI (Ed.) Strength and power in Sports. Oxford, England, Blackwell, p. 211-229, 1992.
-
GOLDSPINK, C., COX, V. M., SMITH, S. K., EAVES, L. A., OSBALDESTON, N. J. LEE, D. M., MANTLE, D. Muscle growth in response to mechanical stimuli. Am. J. Physiol., 268: E288-297, 1995.
-
HARALAMBIE, G., BERG, A. Serum urea and changes with exercise duration. European Journal of Applied Physiology, 36: 138-139, 1976.
-
HECK, H., A. MADER, G. HESS, S. MUCK and W. HOLLMAN. Justification of the 4,0 mmol/L lactate threshold. Int. J. Sports Med. 6: 117-130, 1985.
-
JONES, A. M. and J. H. DOUST. The validity of the lactate minimum test for determination of the maximal lactate steady state and physiological correlates to 8 Km running performance. Med. Sci. Sports Exerc. 30: 1304-1313, 1998.
-
KEE A. D.; COMBARET L.; TILIGNAL T.; SOUWEINE B; AUROUSSEAN E.; DALLE, M.; TAILLANDIER D.; ATTAIX D.. Ubiquitine - proteasome dependent muscle proteolysis responds slowly to insulin release and refeeding in starved rats. Journal of Physiology. 54b: 765 - 776, 2002.
-
KINDERMAN, W.; G. SIMON AND J, KEUL The significance of the aerobic-anaerobic transition for determination of work load intensities during endurance training. Eur. J. appl. Physiol. 42: 25-34, 1979.
-
KRAEMER, W. J., FREEK, S. J., EVANS, W. Strength and power training: physiological mechanisms of adaptation. Exercise and Sport Sciences Reviews. 24; 363-397. 1996.
-
LEMON, PWR, TARNOPPLSKY, M. A., MacDOUGALL, J. D., ATKINSON, S. Protein requirements and muscle mass/strength changes during intensive training in novice bodybuilders. J. Appl. Physiol., 73: 767-775, 1992.
-
LEMON, PWR. Influência da proteína alimentar e do total de energia ingerida no aumento da força muscular. Sports Science Exchange, 10: março/abril, 1997.
-
LEMON, PWR. Protein intake and athletic performance. Sports Med. , 12: 313-325, 1991.
-
LEMON, PWR., MULLIN, J. P. Effects of initial muscle glycogen levels on protein catabolism during exercise. J. Appl. Physiol. 48: 624-629, 1980.
-
LEMON, PWR., NAGLE, F.J., MULLIN, J. P., BENEVEGA, N.J. In vivo leucin oxidation at rest and during two exercise intensities. J. Appl. Phhysiol., 53: 947-954, 1982.
-
LEMON. PWR. Effects of exercise on dietary protein requirements. Int. J. sport. Nutr., 8: 426-447, 1998.
-
LOWRY , O. H.; ROSEBROUGH, N. J.; FARR, A. L.; RANDALL, R. J. Protein measurement with the folin phenol reagent. J. Biol. Chem., 193: 265 - 75, 1951.
-
MADER, A. and H., HECK. A theory of metabolic origin of the anaerobic threshold.Int. J. Sports Med. 7 (suppl = 1): 45-65, 1986.
-
MARABLE, N. L., HICKSON, J. F., KORSLUND, M. K., HERBERT, W. G., DESJARDINS, R. F., THYE, F. W. Urinary nitrogen excretion as influenced by muscle building exercise program and protein intake variation. Nut. Rep. Int. 19: 795-805, 1979.
-
McCARDLE, W. D. ; KATCH, F. I.; KATCH, V. L. Fisiologia do Exercício - Energia, Nutrição e desempenho Humano. 3ª ed. Guanabara Koogan, Rio de Janeiro, 1992.
-
MIDAQUI, A. E., TANCREDI, G., NADEAU, A. Effects of physical training on mitochondrial function in skeletal muscle of normal and diabetic rats. Metabolism,Clinical and Experimental, 45: 810-816, 1996.
-
PRADA F. A.; VOLTARELLI, F. A.; OLIVEIRA, C. A. M.; GOBATTO, C. A.; MACEDO, D. U.; Mello, M. A.R. Condicionamento aeróbio e estresse oxidativo em ratos treinados por natação em intensidade equivalente ao Limiar Anaeróbio. Rev. Bras. Ci. E Mov. V.12, p. 29 - 34, 2004.
-
PIERRE, E. F. et al. Effects of training specificity on lactate threshold and VO max. Inst. J. Sports. Med. 11: 267-272, 1990.
-
SJODIN, B. and I., JABOBS. On set of blood lactate accumulation and marathon running performance. Int. J. Sports Med. 2: 23-26, 1981.
-
STEGMANN, K. and KINDERMANN. Comparison of prolonged testes at the individual anaerobic threshold and the fixed anaerobic threshold of 4,0 mmol/L lactate. Int. J. Sports Med. 3: 105-110, 1982.
-
TARNOPOLSKY, M. A., ATKINSON, S., MacDOUGALL, J. D., CHESLEY, A., PHILLIPS, S. SHWARCS, H. P. Evaluation of protein requirements for trained strength athletes. J. Appl. Physiol., 73: 1986-1995, 1992.
-
TARNOPOLSKY, M. A., MacDOUGALL, J. D., ATKINSON, S. Influence of protein intake and training status on nitrogen balance and lean body mass. J. appl. Physiol. , 64: 187-193, 1988.
-
TEGTBUR, U., M. W. BUSSE and K. M. BRAUMANN. Estimation of individual equilibrium between production and catabolism during exercise. Med. Sci. Sports Exerc. 25: 620-627, 1993.
-
TORUN, B., SCRIMSHAW, N.S., YOUNG, V. R. Effect of isometric exercises on body potassium and dietary protein requirements of young men. Am. J. Clin. Nutr., 30: 1983-1993, 1977.
-
VAN LOON, L. J., GREENHAFF, P. L., CONSTANTIN-TEODOSIU, D., SARIS, W. H., WAGENMAKERS, A. J. The effects of increasing exercise intensity on muscle fuel utilization in humans. J. Physiol. 536 (Pt 1): 295- 304, 2001.
-
VOLTARELLI, F. A., GOBATTO, C. A., MELLO, M, A., R. Determination of anaerobic threshold in rats using the lactate minimum test. Braz. J. Med. Biol. Res. v. 35, p. 1389-1394, 2002.
-
VOLTARELLI, F. A.; Mello, M. A. R.; GOBATTO, C. A. Glicogênio muscular e limiar anaeróbio em ratos durante a natação. Motriz, v. 10, p. 25 - 30, 2004.
-
WHITE, T. P., BROOKS, G. A. (U - ¹ C) glucose, alanine and leucine oxidation in rats at rest and two intensities of running. Am. J. Phisiol. , 53: E155-E165, 1988.
-
WINICK , M.; BASEL, J. A.; ROSSO, P. Nutrition and cellular growth. M. Winick. In Nutrition and development; editor, John Willey, p. 49 - 97, 1972.
| |
|
|---|---|
|
revista
digital · Año 10 · N° 93 | Buenos Aires, Febrero 2006 |
|