|
|||
|---|---|---|---|
|
|
Un método de recogida del sudor durante el ejercicio |
|
|
|
Departamento de Fisiología Universidad de León (España) |
Dr. Ildefonso Alvear-Ordenes dfiiao@unileon.es Dr. José Antonio de Paz Fernández dfijap18@unileon.es Dr. Javier González Gallego dfijgg@unileon.es |
|
|
|
|
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 9 - N° 63 - Agosto de 2003 |
|
|
1 / 1
Introducción
Una de las situaciones que se ve más asociada a la realización de un ejercicio es la sudoración. En ella se representa el punto donde la intensidad del ejercicio provoca un grado de estrés térmico lo suficientemente elevado para que el organismo se vea en la obligación de utilizar el mecanismo de la sudoración. En estas circunstancias, la eliminación del sudor representa no sólo el intento del hipotálamo por controlar la temperatura, sino también la pérdida de muchos elementos excretados junto con el fluido producido durante la actividad glandular ecrina.
El sudor se ha definido como un ultrafiltrado del plasma. Los componentes excretados a través del sudor pueden servir como referencia clínica para la evaluación de diferentes elementos que también encontramos en el plasma. Iones, minerales, residuos nitrogenados, aminoácidos, vitaminas y productos farmacéuticos entre otros elementos, pueden ser analizados en el sudor humano sin necesidad de introducir elemento alguno dentro del cuerpo ni de tomar muestras de sangre. Es importante hacer notar que existe cada día más una mayor reticencia de las personas y de los deportistas a verse enfrentados a un análisis sanguíneo, situación que estimula el estudio de vías no invasivas de análisis clínico y deportivo.
En los últimos cien años, los métodos de recogida del sudor han sido tan variados como la imaginación lo ha permitido. Cuando comparamos los diferentes métodos utilizados, se observan fuertes diferencias en el tiempo de recogida, en las áreas de piel desde donde se han obtenido las muestras y en los métodos utilizados para estimular la sudoración. Una gran diferencia puede apreciarse en la recogida experimental de sudor en los animales, como en el gato por ejemplo, en donde las muestras de sudor se han recogido siempre desde uno de los cojines de la pata y por el mismo tipo de estimulación (Brusilow, 1967; Foster, 1966). Sin embargo, en el hombre, además de obtener muestras de diferentes partes del cuerpo, el sudor se ha recogido con gasas, filtros e infinidad de otros procedimientos.
Estas diferencias metodológicas han dificultado considerablemente la comparación de los datos obtenidos durante la actividad sudoral, provocando rangos muy amplios de excreción para los diferentes componentes que encontramos en el sudor. Por ello, es importante definir y establecer un método práctico que permita recoger un volumen de sudor adecuado y libre de contaminaciones. El método que presentamos en este trabajo es el resultado de nuestra experiencia (Alvear-Ordenes, 2003; Alvear-Ordenes y cols., 2001; Alvear-Ordenes y cols., 1999; Alvear, 1998; Alvear y Flegner, 1996). Durante su aplicación, este método ha resistido sin desprenderse la recogida de muestras de sudor de más de dos horas de ejercicio continuo, así como del sudor acumulado durante la aplicación de un protocolo de saunas intermitentes durante una hora. Hemos aplicado este método en corredores de maratón, de media maratón, en triatletas, en ciclistas profesionales y en jugadores de rugby; tanto en campo como en el laboratorio. Incluso, experimentalmente, ha resistido más de 36 horas de recogida de sudor durante la realización de actividades cotidianas. En estas circunstancias el límite observado no se produce por una pérdida de la adherencia de las láminas, sino por una respuesta alérgica aparentemente provocada por el propio sudor acumulado (Matsumura y cols., 1995).
Durante su historia y como señalábamos anteriormente, los métodos aplicados para recoger el sudor han variado desde el simple lavado de las camisas o de las ropas utilizadas por los deportistas (Snapper y Grünbaum, 1929), al lavado de todo el cuerpo (Colombani y cols., 1997; Gordon y cols., 1971; Dill y cols., 1967; Dill y cols., 1966), o de las ropas y el cuerpo (Colombani y cols., 1997; Lamont, 1987), hasta métodos tan sofisticados como recoger el sudor a través de un pequeño tubo capilar aplicado directamente sobre el ducto glandular de un dedo. Método, este último, inviable cuando realizamos ejercicio.
En los años cuarenta, se realizaron varios estudios para determinar en el sudor las concentraciones de urea, de ácido úrico, de amoníaco, de glucosa, entre otros productos (Lobitz y Mason, 1948a; 1948b; 1948c). Sin embargo, en estos trabajos el sudor fue recogido desde la palma de la mano; un área de recogida que también es considerablemente limitante durante ejercicio.
Durante el ejercicio, diversos estudios han realizado recogidas de sudor desde otras áreas corporales, como la zona hipogástrica, la espalda superior, la zona lumbar, el pecho, etc. (Alvear-Ordenes y cols., 2001; Marins, 2000; Ament y cols., 1997; Colombani y cols., 1997; Meyer, 1993; Boisvert y cols., 1993; Falk y cols., 1991; Czarnowski y Górski, 1991b; Brisson y cols., 1991; Kolka y Stephenson, 1989; Aruoma y cols., 1988; Kolka y cols., 1987; Hjelm y cols., 1986; Fortney y cols., 1981; Araki y cols., 1981; Allan y Wilson, 1971; Brusilow y Gordes, 1968; Geschickter y cols., 1966; Amatruda y Welt, 1953).
De todas ellas, nosotros recomendamos la zona superior de la espalda, entre el área inferior o superior de la escápula. Esta zona posee varios aspectos positivos. Es una zona de bajo contacto durante ejercicio; es un área de piel que posee uno de los mayores índices de sudoración, permitiendo recoger mayores volúmenes de sudor dentro de la lámina. Además, es una de las áreas del cuerpo que primero inician la sudoración, por lo que este mayor volumen de sudor puede ser recogido en períodos más cortos de ejercicio; y, por último, es una zona de fácil acceso y manipulación durante el ejercicio, especialmente en el laboratorio.
Los primeros estudios que utilizaron gasa estéril para recoger sudor fueron realizados en Polonia (Czarnowski y cols., 1992; Czarnowski y Górski, 1991a; 1991b). Con este método pudo observarse que el sudor acumulado en la gasa puede ser centrifugado y analizado sin grandes dificultades. Sin embargo, el método de adherencia aplicado por estos autores no era el más adecuado para resistir por largos períodos de tiempo las fuertes inflexiones de la piel y el elevado índice de sudoración. Por este motivo, el principio de recogida de sudor utilizando gasas para absorber el sudor, requirió de fuertes modificaciones, cambiando por completo los diferentes componentes que formaban la cápsula que contenía la gasa adherida a la piel. La gasa es también importante porque disminuye el contacto directo de la piel con la lámina utilizada, evitando un aumento excesivo de la temperatura.
La cápsula de recogida de sudorLa recogida de sudor se realiza por medio de la fijación de una lámina de látex natural unida a una lámina de alta adherencia y colocando una gasa estéril entre el látex y la piel. La aplicación del método de recogida de sudor exige también la preparación de la piel antes de la colocación de las láminas.
El método utiliza un área de piel de 24 cm22 en cada lámina de recogida, pudiendo ser colocadas varias láminas en el mismo sujeto. En nuestros ensayos hemos colocado hasta 4 pares de láminas, a ambos lados de la espalda, siguiendo ambas lineas escapularis (Figura 1).
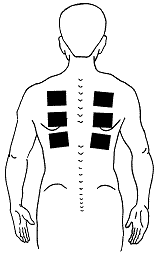
Figura 1: Distribución de las cápsulas siguiendo la línea escapularis de ambos lados de la espalda.
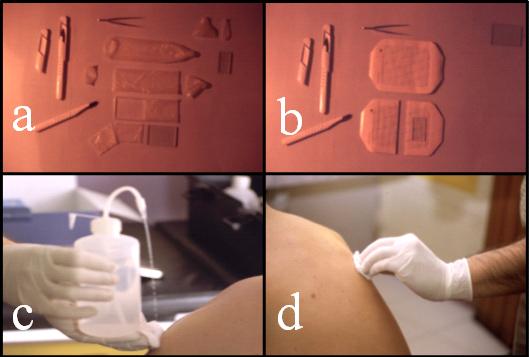
Confección de las láminasDos láminas componen la cápsula, una lámina de látex natural adherida a otra lámina mayor de Tegaderm. La confección de las cápsulas debe ser realizada con guantes y material estéril. Las láminas de látex (6 x 4 cm) son previamente cortadas a partir de preservativos no lubricados. Primero, con un bisturí, se corta la punta y el anillo del preservativo (Fig. 1a). Luego, con la ayuda de un molde de vidrio (4 x 6 cm) se obtienen 4 láminas desde cada preservativo. El látex que utilizamos es donado por la Indústria Nacional de Artefatos de Látex, Ltda. (INAL), São Paulo, Brasil. Este material se caracteriza por ser liso, opaco y con una espesura mínima de 45 mm (0,045 mm). El látex es evaluado electrónicamente y se desechan las láminas con perforaciones o porosidades mayores de 100 nm de diámetro (Alvear, 1998).
La lámina de Tegaderm es modificada previamente desde una lámina mayor (modelo 1626W, de 10 x 12 cm), cortándola en dos láminas de 10 cm x 5,7 cm (Fig. 1b). Posteriormente, y con la ayuda de un molde de vidrio (4,4 x 2,4 cm), se realizan cuatro cortes sobre la lámina para abrir un rectángulo central de 4,4 cm x 2,4 cm; en esta ventana se fijará posteriormente la lámina de látex.
Las láminas cortadas de látex y de Tegaderm, se guardan en unas cajas metálicas estériles, en un ambiente seco y fresco hasta su utilización.
La unión de la lámina de Tegaderm y de la lámina de látex se realiza momentos antes de la colocación de la cápsula en la piel. Esta estructura otorga a la cápsula una elevada elasticidad y resistencia.
Las láminas que se adhieren a la piel y no poseen esta elasticidad, pueden reventar cuando la recogida de sudor supera una hora (Alvear, 1998). En estas condiciones, el elevado volumen de sudor y la acumulación de gas dentro de la cápsula terminan por disminuir la capacidad de adherencia de las cápsulas normales.
Colocación de las láminasPreviamente a la colocación de las cápsulas la piel debe ser preparada. Utilizando guantes desechables, jabón no iónico (Texapón) y agua destilada, la piel es rasurada cuidadosamente para no provocar cortes. Se recomienda que la piel sea rasurada el día anterior, de esta manera se evitarán zonas irritadas en el momento de colocar las láminas en la piel. Sin embargo, con el cuidado adecuado, este procedimiento puede realizarse momentos antes de la limpieza de la piel y de la colocación de las cápsulas.
Las láminas son colocadas en la regio scapularis, sobre la linea scapularis (IANC, 1983), y su adherencia no se ve perjudicada por la utilización de los cinturones elásticos utilizados para registrar la frecuencia cardiaca.
Momentos antes de montar las láminas y utilizando gasas estériles, la piel es lavada con agua milli-Q que ha de ser obtenida dentro de las últimas 24 h a la recogida de sudor. Esto permite obtener un área limpia y desinfectada, para que la muestra de sudor esté libre de residuos y de actividad biológica. (Alvear y Flegner, 1996). Posteriormente, la piel es lavada nuevamente con alcohol etílico de alta pureza, diluido al 70% con agua Milli-Q, dejándola secar por unos minutos.
La solución de alcohol en H2O destilada, es comúnmente recomendada y utilizada en la recogida de muestras de sudor (Czarnowski y cols., 1992; Czarnowski y Górski, 1991b). Esta mezcla forma una solución altamente reactiva, aumentando su función desinfectante (Bier, 1966).
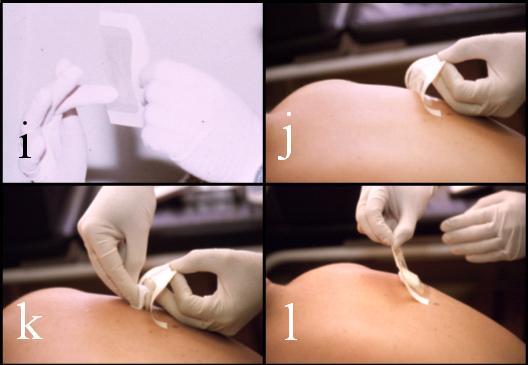
Con el área de piel limpia y seca, se fija la parte inferior de la lámina de Tegaderm a la piel y, antes de cerrar la cápsula, se introduce una gasa estéril, 100% algodón, de 5 x 5 cm y 0,5 g de peso (Alvear-Ordenes, 2003; Alvear-Ordenes y cols., 1999; Alvear, 1998; Colombani y cols., 1997; Alvear y Flegner, 1996; Czarnowski y Górski, 1991b). Es así que la gasa queda cubierta con una lámina de látex natural de 6 cm x 4 cm y sobre ella, como fijación, la lámina precortada de Tegaderm (Figura 1 a la 2).
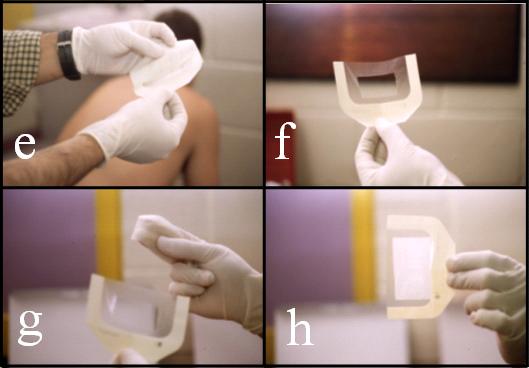
Figura 2. Confección y colocación de las láminas. Secuencia fotográfica: (a) y (b), corte de las láminas de látex y TegadermÒ; (c) y (d) limpieza y lavado de la piel, (e), (f), (g) y (h), preparación de la lámina de TegadermÒ para el montaje de la lámina de látex.
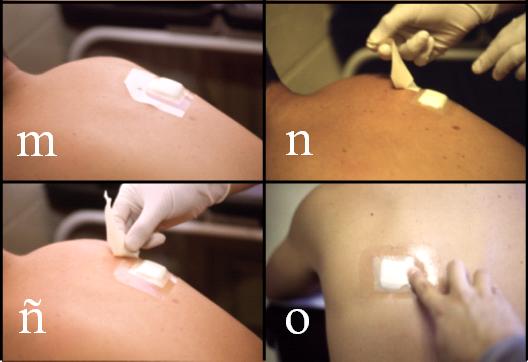
Figura 3. Confección y colocación de las láminas. Continuación: (i) y (j), montaje del látex; (k), (l), (m) y (n), colocación de la gasa y de la lámina; y, (ñ) y (o), retirada de monturas de papel.
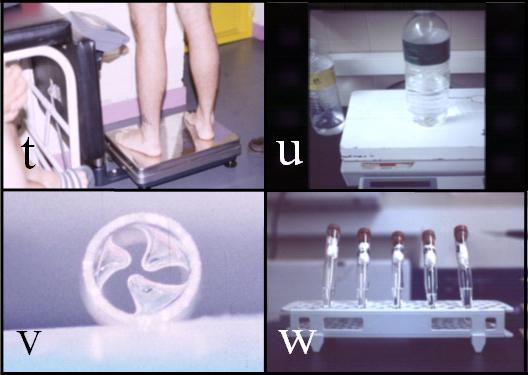
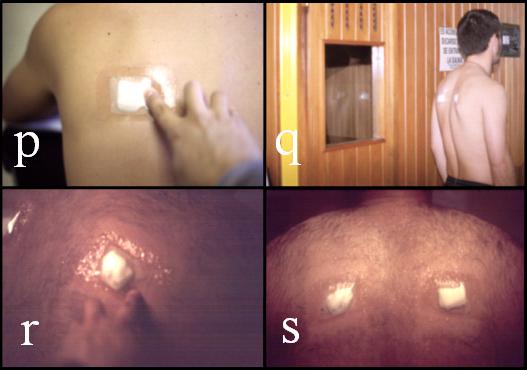
Figura 4. Confección y colocación de las láminas. Continuación: (p) y (q), estado previo de las láminas de recogida de sudor; (r) y (s), estado posterior de las láminas; (t), segundo registro de PC; (u), registro del peso del agua consumida; (v), detalle de un corte de tubo modificado; y, (w), sudor recién centrifugado.
Recogida del sudor
El sudor es separado de la gasa por centrifugación. El método consiste en colocar las gasas inmediatamente después de retiradas de la piel, en tubos de centrifugación de 12 ml. A continuación deben ser tapados herméticamente con tapas de goma siliconada (del tipo Vacutainer) y centrifugados a 3 000 rpm por un tiempo de 3 min, separando el sudor de la gasa (Figura 3w). Se recomienda la centrifugación en cámara fría (4 ºC) o centrífuga con control de temperatura. La muestra recogida se guarda en crioviales y se congela en N22 líquido hasta su posterior análisis (Alvear-Ordenes y cols., 1999).
Los tubos deben ser previamente modificados para estos estudios, estrechando la zona final del primer tercio del tubo a través de tres hundimientos y estrangulando de esta forma su diámetro interno (Figura 3v y 3w). Esta deformación permite que la gasa se fije en la parte superior del tubo, mientras el sudor se deposita en el mismo. La fuerza provocada por la centrifugación separa el sudor de ella. Para modificarlos, los tubos deben estar fabricados en cristal tipo Pirex.
Recapitulando
La utilización de gasas para absorber el sudor excretado en un área específica de piel, es un método simple y de gran valor para recoger este tipo de muestras (Colombani y cols., 1997).
El método de recogida de sudor en gasas tiene sus inconvenientes, como es el de desconocer los cambios que pueden producirse en los períodos intermedios, ya que solo tendremos un valor inicial y un valor final. Es excelente para medir valores acumulados en el sudor, pero pierde su eficacia cuando queremos tener curvas de comportamiento de las variables que podemos medir en el sudor excretado. Para este caso hemos aplicado varias cápsulas (hasta seis) en la misma zona de la piel, lo que nos ha permitido obtener la relación de variables en el sudor a diferentes tiempos de un esfuerzo prolongado (Alvear-Ordenes y cols., 2001; Alvear, 1998).
En este trabajo estamos presentando sólo el método de recogida de sudor que utilizamos. Sin embargo, en el estudio del sudor, por ser la fracción líquida que pierde el cuerpo, debe considerarse siempre el control del peso corporal perdido, con la mayor precisión posible. Debemos considerar que a través de la respiración se elimina una parte importante del peso corporal, tanto por el volumen de agua perdida en forma de vapor, como por la fracción del peso corporal que se pierde en forma de carbono durante el intercambio de CO2/O2. Estos aspectos son importantes cuando medimos el volumen de sudor perdido durante más de media hora, especialmente en condiciones extremas de ejercicio, de elevado calor o de ambos.
Bibliografía
-
ALLAN, J.R., WILSON, C.G. (1971). Influence of acclimatization on sweat sodium concentration. J Appl Physiol. 30(5):708-712.
-
ALVEAR, I., FLEGNER, A.J. (1996). Método simples de coleta de suor em humanos. Rev Mineira Educ Física 4(2):97.
-
ALVEAR, I. (1998). Índice de excrecão de amoníaco no suor em atletas de fundo durante exercício até exaustão. (Tesis de Mestrado). Universidade Federal do Rio de Janeiro.
-
ALVEAR-ORDENES, I., VILLA, J.G., DE PAZ, J.A., GONZÁLEZ-GALLEGO, J. (1999). Método de recogida de sudor en deportistas. Arch Med Dep. XVI(Especial):536.
-
ALVEAR-ORDENES, I., FLEGNER, A.J., GONZÁLEZ-GALLEGO, J. (2001). Índice de excreción de amoníaco en el sudor de atletas de fondo durante ejercicio hasta la fatiga. Arch Med Dep. XVIII(86):593-599.
-
ALVEAR-ORDENES, I. (2003). Efectos del ejercicio físico sobre los niveles de amoníaco y urea en el sudor y en la sangre: relación con el daño muscular. (Tesis Doctoral). Universidad de León.
-
AMATRUDA, T.T., Jr., WELT, L.G. (1953). Secretion of electrolytes in thermal sweat. J Appl Physiol. 5(12):759-772.
-
AMENT, W., HUIZENGA, J.R., MOOK, G.A., GIPS, C.H., VERKERKE, G.J. (1997). Lactate and ammonia concentration in blood and sweat during incremental cycle ergometer exercise. Int J Sports Med. 18(1):35-39.
-
ARAKI, T., MATSUSHITA, K., UMENO, K., TSUJINO, A., TODA, Y. (1981) Effect of physical training on exercise-induced sweating in women. J Appl Physiol. 51(6):1526-1532.
-
ARUOMA, O.I., REILLY, T., MacLAREN, D., HALLIWELL, B. (1988). Iron, copper and zinc concentrations in human sweat and plasma; the effect of exercise. Clin Chim Acta. 177(1):81-88.
-
BIER, O. (1966). Técnicas bacteriológicas gerais. En: Bacteriología e Imunología, em suas aplicações à Medicina e à Higiene. (13ªed.). São Paulo: Melhoramentos, p. 800-820.
-
BOISVERT, P., NAKAMURA, K., SHIMAI, S., BRISSON, G.R., TANAKA, M. (1993). A modified, local sweat collector for warm and humid conditions. Eur J Appl Physiol. 66(6):547-551.
-
BRISSON, G.R., BOISVERT, P., PÉRONNET, F., PERRAULT, H., BOISVERT, D., LAFOND, J.S. (1991). A simple and disponsable sweat collector Eur J Appl Physiol. 63(3-4):269-272.
-
BRUSILOW, S.W. (1967). Evidence for a non-plasma source of urea in sweat. Nature. 214(5087):506.
-
BRUSILOW, S.W., GORDES, E.H. (1968). Ammonia secretion in sweat. Am J Physiol. 214(3): 513 -517.
-
COLOMBANI, P., SPÄTI,S,M SPLEISS, C., FREY-RINDOVA, P., WENK, C. (1997). Exercise-induced sweat nitrogen excretion: evaluation of a regional collection method using gauze pads. Z Ernährungswiss. 36(3):237-243.
-
CZARNOWSKI, D., GÓRSKI, J. (1991a). [Excretion of nitrogen compounds in sweat during a sauna]. Pol Tyg Lek. 4(46):186-187.
-
CZARNOWSKI, D., GÓRSKI, J. (1991b). Sweat ammonia excretion during submaximal cycling exercise. J Appl Physiol. 70(1):371-374.
-
CZARNOWSKI, D., GÓRSKI, J., JÓZWIUK, J., BORON-KACZMARSKA, A. (1992). Plasma ammonia is the principal source of ammonia in sweat. Eur J Appl Physiol. 65:135-137.
-
DILL, D.B., HALL, F.G., van BEAUMONT, W. (1966). Sweat chloride concentration: sweat rate, metabolic rate, skin temperature, and age. J Appl Physiol. 21(1):99-106.
-
DILL, D.B., HORVATH, S.M., van BEAUMONT, W., GEHLSEN, G., BURRUS, K. (1967). Sweat electrolytes in desert walks. J Appl Physiol. 23(5):746-751.
-
FALK, B., BAR-OR, O., MacDOUGALL, J.D., McGILLIS, L., CALVERT, R., MEYER, F. (1991). Sweat lactate in exercising children and adolescents of varying physical maturity. J Appl Physiol. 71(5):1735-1740.
-
FORTNEY, S.M., NADEL, E.R., WENGER, C.B., BOVE, J.R. (1981). Effect of blood volume on sweating rate and body fluids in exercising humans. J Appl Physiol. 51(6):1594-1600.
-
FOSTER, K.G. (1966). Composition of the secretion from the eccrine sweat glands of the cat's foot pad. J Physiol (London). 184(1):106-119.
-
GESCHICKTER, E.H., ANDREWS, P.A., BULLARD, R.W. (1966). Nocturnal body temperature regulation in man: a rationale for sweating in sleep. J Appl Physiol. 21(2):623-630.
-
GORDON, R.S., Jr., THOMPSON, R.H., MUENZER, J., THRASHER, Del. (1971). Sweat lactate in man is derived from blood glucose. J Appl Physiol. 31(5):713-716.
-
HJELM, M., BROWN, P., BRIDDON, A. (1986). Sweat sodium related to amount of sweat after sweat test in children with and without cystic fibrosis. Acta Paediatr Scand. 75(4):652-656.
-
KOLKA, M.A., STEPHENSON, L.A. ROCK, P.B., GONZALEZ, R.R. (1987). Local sweating and cutaneous blood flow during exercise in hypobaric environments. J Appl Physiol. 62(6):2224-2229.
-
KOLKA, M.A., STEPHENSON, L.A. (1989). Control of sweating during the human menstrual cycle. Eur J Appl Physiol. 58:890-895.
-
LAMONT, L.S. (1987). Sweat lactate secretion during exercise in relation to women's aerobic capacity. J Appl Physiol. 62(1):194-198.
-
LOBITZ, W.C. Jr., MASON, H.L. (1948a). Chemistry of palmar sweat. V. Ammonia nitrogen. Arch Dermatol Syphilol. 57(1):69-73.
-
LOBITZ, W.C. Jr., MASON, H.L. (1948b). Chemistry of palmar sweat. VI. Uric Acid. Arch Dermatol Syphilol. 57(3):387-391.
-
LOBITZ, W.C. Jr., MASON, H.L. (1948c). Chemistry of palmar sweat. VII. Discussion of studies on chloride, urea, glucose, uric acid, ammonia nitrogen and creatinine. Arch Dermatol Syphilol. 57(5):907-915.
-
MARINS, J.C.B. (2000). Estudio comparativo de diferentes procedimientos de hidratación durante un ejercicio de larga duración. (Tesis Doctoral). Universidad de Murcia.
-
MATSUMURA, H., OKA, K., UMEKAGE, K., AKITA, H., KAWAI, J., KITAZAWA, Y., SUDA, S., TSUBOTA, K., NINOMIYA, Y., HIRAI, H. (1995). Effect of occlusion on human skin. Contact Dermatitis. 33(4):231-235.
-
MEYER, F. (1993). Water and Electrolyte Losses and Replenishment in Children During Prolonged Exercise in the Heat: Physiological and Percentual Consideration. (A Thesis for Doctor of Philosophy) McMaster University - Canada.
-
SNAPPER, I., GRÜNBAUM, A. (1929). Excretion of lactic acid during sport. Am J Physiol. 90(2):519-520.
| |
|
|---|---|
|
revista
digital · Año 9 · N° 63 | Buenos Aires, Agosto 2003 |
|