
|
|||
|---|---|---|---|
|
|
Hormona del crecimiento: fisiología y acción en el ejercicio |
|
|
|
*Neurobióloga *Nutricionista (Argentina) |
Lic. María Fernanda Insua* mfinsua@criba.edu.ar Lic. Karina Fuks** fuks@fibertel.com.ar |
|
|
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 9 - N° 62 - Julio de 2003 |
|
|
1 / 1
La somatotrofina u hormona del crecimiento (GH) es la hormona promotora del crecimiento.
Fisiología de la GHLa GH es una proteína de 191 aminoácidos. El gen humano de esta hormona es un integrante de una familia de genes formada por 5 miembros, que se encuentra en el cromosoma17.
Este gen sólo se expresa en las células somatotropas de la pituitaria anterior, que son las productoras de GH. Una vez sintetizada en el retículo endoplásmico, esta se transporta a gránulos de secreción que son liberados ante un estímulo.
Estas células productoras de GH son las más numerosas de la pituitaria. En ratas macho, constituyen entre el 30-40% de las células de la pituitaria, mientras que en hembras dicho valor es de 20-30%.
Cerca de la mitad de la GH secretada, es transportada a través de la circulación en asociación a proteínas que se unen a ella (GHBP).
Todos los tejidos sensibles a la GH poseen receptores (GH-R) en las membranas de sus células. Para que la hormona ejerza su efecto se requiere que se una a estos receptores, los cuales una vez activados, inician una cascada de fosforilaciones de proteínas intermedias, que eventualmente conducen a la activación en el núcleo de factores de transcripción y a los efectos estimulatorios sobre los genes regulados por GH.
Tiene una vida media en el plasma de entre 15 y 20 min luego de la secreción o de una inyección intravenosa. Luego de una inyección subcutánea o intramuscular, las concentraciones sanguíneas de GH alcanzan un pico entre 1 y 3 horas posteriores a la inyección y cae hasta niveles indetectables luego de 24 hrs.
La GH circulante se elimina de la sangre a través de una degradación mediada por receptores, principalmente en el hígado y el riñón. Estos órganos internalizan los complejos GH-receptor y completan la degradación hasta obtener los aminoácidos. Solamente mínimas cantidades de GH aparecen en la orina.
Los mayores estímulos para la secreción de GH en el hombre son el sueño, el estrés y el ejercicio.
La GH estimula varios procesos metabólicos en todas las células, pero una de las acciones mejor entendidas, es la producción de IGF-I. La GH estimula la expresión del gen de IGF-I en todos los tejidos. En la mayoría de ellos, el IGF-I ejerce acciones locales autócrinas y parácrinas, pero el hígado secreta activamente IGF-I hacia la circulación.
Hasta hace poco tiempo se creía que este IGF-I era el responsable de muchas de las acciones de GH in vivo. Datos más recientes muestran que el IGF-I circulante debe ser considerado más como un "marcador" de la acción de GH en el hígado que como un mecanismo por el cual la GH ejerce sus efectos. Al respecto, hay fuertes evidencias de un rol central de IGF-I en el mantenimiento de la masa muscular esquelética y en la hipertrofia y se ha postulado que la falta de IGF-I sea una de las causas por las cuales el músculo esquelético pierde masa y fuerza con el transcurso de la edad.
Secreción de GH: pulsatilidadLa secreción espontánea de GH es pulsátil. Los intervalos entre los pulsos varían según las especies, y son aproximadamente de 2 hs. en humanos y de 3 hs. en ratas.
El patrón de secreción de GH depende de la interacción finamente regulada de la GHRH con la SS en las células somatotropas, es decir que tanto la GHRH como la SS son requeridas para la secreción pulsátil de GH.
El patrón secretorio de GH es sexualmente dimórfico; los machos exhiben pulsos mayores.
El patrón es influenciado por andrógenos y estrógenos: mientras que los primeros regulan la amplitud del pulso, los estrógenos, regulan la secreción basal. A pesar de que los andrógenos y los estrógenos pueden afectar la expresión del gen de la GH en la pituitaria, sus efectos sobre el ritmo ultradiano de la secreción de GH, indica que tienen influencia en la secreción de GHRH y/o SS.
En humanos, un pico en la secreción de GH se observa asociado al sueño profundo (estados III y IV) y el 70% de la secreción de GH ocurre durante la noche.
Un número de patrones de dimorfismo sexual observado en enzimas, receptores y otras proteínas, puede ser atribuible a diferentes patrones de secreción de GH en machos y hembras
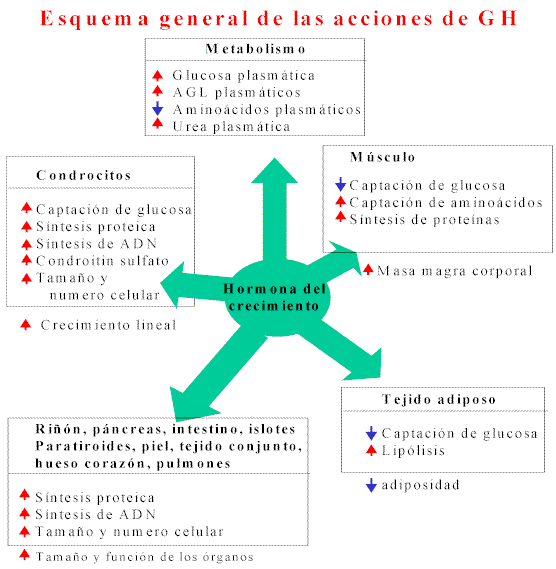
Acciones de la GH1° Anabolica: La somatotrofina cumple actividades anabólicas críticas para la homeostasis metabólica.
La principal acción de la GH es estimular la síntesis de proteínas. Es al menos tan poderosa como la testosterona, y sus efectos individuales son aditivos o posiblemente sinergísticos. Además para estimular la síntesis proteica, la GH simultáneamente moviliza grasa por acción lipolítica directa.
Parece más probable que estimule la síntesis de proteína a través de la movilización de transportadores de aminoácidos, en una manera análoga a los trasportadores de glucosa e insulina. El efecto promotor del crecimiento de la GH requiere de numerosos factores, incluyendo efectores nutricionales (principalmente proteínas), reguladores hormonales (Ej.: insulina y hormona tiroidea), factores específicos de tejidos y factores genéticos. De hecho, cuando se utiliza STH por vía erógena, como las necesidades del organismo de las otras hormonas aumentan; (tiroides, insulina, cortico-esteroides, gonadotrofina, estrógenos) esto produce una verdadero desequilibrio en el delicadísimo sistema de regulación hormonal.
2° Acción sobre el metabolismo de los carbohidratos: ejerce acciones semejantes a las que realiza la insulina, que aumenta la captación y la utilización de glucosa y aminoácidos durante las comidas. Sin embargo, los efectos opuestos ejercidos por la GH y la insulina, son de gran relevancia fisiológica.
3° Acción lipolítica que se opone a los efectos lipogénicos de la insulina, y moviliza ácidos grasos para su uso como fuente de combustible durante el ayuno.
4° Estimula el crecimiento de los órganos (ej.: hipertrofia cardiaca y renal), la producción de hormonas, el metabolismo, el crecimiento y la maduración esqueletaria, y la función inmune. Estos efectos son más fácilmente visibles durante el tratamiento con somatostatina en humanos con deficiencias en su producción o en animales con GH exógena. Para la expresión máxima, muchos de estos efectos los tejidos requieren una exposición intermitente, más que continua, a la GH.
Entre otros efectos, la GH estimula la producción del factor de crecimiento semejante a la insulina-I (IGF-I)
La administración de GH aumenta la síntesis proteica, que se refleja en un balance de nitrógeno positivo y un descenso en la producción de urea, y un aumento de la lipólisis, resultando en una disminución de la grasa corporal.
Niveles según etapas del crecimientoTiene un rol limitado en el crecimiento fetal, pero es importante en el período neonatal (los niveles más altos de GH se observan justo antes del nacimiento y durante el período postnatal inmediato).También juega un rol muy importante en el crecimiento durante la adolescencia. Se estabiliza en la adultez para decaer pasados los 35 años.
Control de su liberación: eje cerebro-pituitario independienteEn este eje, el hipotálamo produce dos hormonas principales: - la hormona liberadora de hormona del crecimiento (GHRH) y - somatostatina (SS, también conocida como hormona inhibidora de la liberación somatotropa, SRIH). Estas hormonas tienen efectos opuestos en la liberación de somatotrofina: la GHRH estimula la liberación de la misma, mientras que la SS la inhibe.

Los inputs neurales hacia el hipotálamo, permiten al eje responder a los sueños y a los ritmos ultradianos, al estrés físico y emocional, y al incremento y descenso del apetito.
La secreción de estas dos hormonas hipotalámicas también responde a otras hormonas, como esteroides sexuales, glucocorticoides y hormona tiroidea.
En respuesta a la GHRH, las células somatotropas que se hallan en la pituitaria anterior liberan somatotrofina a la circulación sistémica.
A diferencia de los ejes cerebro-pituitaria-tiroides, y cerebro-pituitaria-adrenal, en los que cada uno controla la actividad del tejido target o blanco (ej.: tiroides y corteza adrenal), el eje cerebro-pituitaria que controla la somatotrofina carece de un único y principal órgano target.
En cambio, la GH liberada de la región anterior de la pituitaria, afecta directamente a varios tejidos.
Células de una variedad de tejidos expresan receptores para GH en su superficie. Esta se une a esos receptores para cumplir su rol esencial en el crecimiento, la regeneración de tejidos y la homeostasis metabólica.
Como sucede con otros ejes cerebro-pituitaria, se necesita de una retroalimentación (feedback) negativo para la apropiada regulación de este eje: la GH retroalimenta hacia el hipotálamo para inhibir su propia liberación.
El gen de la GHRH está localizado en el cromosoma 20, que codifica para un precursor de 108 aminoácidos (preproGHRH), el cual, luego de ciertas modificaciones, origina la forma biológicamente activa.
La somatotrofina o GH es el regulador más importante de la expresión génica de la GHRH. Otras hormonas también afectan su expresión. La testosterona por ejemplo, hace que los niveles de GHRH sean mayores en ratas y ratones machos que en hembras. También la administración del factor trófico semejante a la insulina (IGF-I) directamente en el sistema nervioso central, pero no periféricamente, suprime los niveles de GHRH.
El mayor sitio de producción de GHRH es el hipotálamo basomedial.
Regulación del gen de la GHRH: señales metabólicasCuatro alteraciones metabólicas han sido asociadas a cambios en la expresión del gen de la GHRH: 1) diabetes, 2) obesidad genética, 3) toxicidad por etanol y 4) deprivación proteica. En ratas diabéticas, los niveles de GHRH se encuentran disminuidos y los niveles normales pueden ser restituidos mediante un tratamiento con insulina a dosis suficientes como para permitir la re-adquisición del peso corporal, aunque no para restituir la euglucemia y normalizar los niveles de somatostatina (SS). En ratas con obesidad genética, los niveles de GHRH también se encuentran disminuidos, pero como los niveles de GH también se hallan reducidos, este cambio es independiente de la regulación negativa por somatotrofina. Similares cambios se dan en ratas intoxicadas con etanol. La deficiencia de proteínas, y más específicamente, la deficiencia de un sólo aminoácido, la histidina, conduce a una disminución en los niveles de GHRH. En roedores, cada una de estas perturbaciones se encuentra asociada con una disminución en la secreción de somatotrofina. Sin embargo, en humanos, la diabetes y la malnutrición proteica resulta en un aumento de la secreción de somatotrofina; por lo tanto la regulación metabólica es distinta según la especie.
Los neurotransmisores
La secreción de GHRH es pulsátil y es suprimida (como también lo es la secreción de GH) por hipoglucemia inducida por insulina y por deprivación proteica.
La secreción de GHRH es estimulada por los sistemas b-adrenérgicos, dopaminérgicos y serotoninérgicos.
Otros sistemas de neurotransmisores y agentes metabólicamente activas, estimulan (ej: aminoácidos) o inhiben (ej: glucosa, ácidos grasos) la secreción de GH, aunque no se sabe si estos efectos ocurren a través de cambios en la secreción de GHRH, SS o ambos.
Estudios in vitro también han revelado un efecto inhibitorio del IGF-I y de SS.
Las mediciones de GHRH realizadas en humanos son indirectas (se mide GH en lugar de GHRH), porque el acceso a la sangre portal es complicado.
Somatostatina (SS)El gen humano de la SS se encuentra en el cromosoma 3, que codifica un precursor de 116 aminoácidos (preproSS). Las neuronas que producen SS, a diferencia de las que producen GHRH, se encuentran localizadas en toda la extensión del SNC, pero principalmente en la región anterior del hipotálamo, y participan en muchas otras vías no relacionadas con GH.
Regulación de la somatostatinaEl principal regulador es la somatotrofina (GH).
Al igual que lo que sucede con la GHRH, los niveles se SS son mayores en ratas machos que en hembras y son incrementados por la acción de la testosterona. También la administración directa en el SNC, aumenta la expresión del gen SS.
Señales metabólicas también regulan la expresión de este gen. La hipoglucemia y la hiperglucemia incrementan los niveles de SS. En animales con diabetes, los niveles de SS se hallan aumentados.
Se sabe también que la GH, el IGF-I y la GHRH estimulan la liberación de SS. Muchos neuropéptidos incluyendo la hormona liberadora de tirotrofina, la GHRH, la secretina, el glucagón y la neurotensina, estimulan la secreción de SS cuando son administrados directamente en el SNC.
Los efectos inhibitorios de la SS sobre la síntesis de GH y la proliferación de células somatotropas se debe aparentemente a la modulación de la acción de la GHRH.
Otras hormonas y sustratos metabólicos que afectan la secreción de GHLa hormona tiroidea, los glucocorticoides, los andrógenos, los estrógenos y otros sustratos metabólicos influencian la secreción de GH. Los mayores efectos de la hormona tiroidea ocurren en la pituitaria, ocasionando la expresión aumentada del gen de la GH y la consecuente síntesis de GH.
Las hormonas glucocorticoideas contribuyen a la regulación de la secreción a nivel pituitario e hipotalámico. En la pituitaria, y al igual que la hormona tiroidea, contribuyen a incrementar la expresión del gen de la GH.
Los efectos de los esteroides sexuales son complejos. En la pituitaria, los andrógenos aumentan la expresión del gen de la GH, mientras que los estrógenos la disminuyen. Por lo tanto las hembras poseen una menor concentración de GH en la pituitaria que los machos.
Los combustibles metabólicos ejercen su principal efecto a nivel hipotalámico. La deprivación de proteínas ha sido largamente reconocida por disminuir la secreción de GH.
Alteraciones en el metabolismo de la glucosa también afecta profundamente la secreción de GH; la hiperglucemia incrementa la secreción de GH y la hipoglucemia inducida por insulina, la aumenta en humanos. Cambios en la concentración plasmática de los ácidos grasos libres o no esterificados (NEFA), también pueden afectar la secreción de GH. Incrementos de NEFA, suprimen la liberación de GH, y descensos, la aumentan. Las elevaciones de NEFA en el suero, bloquea los efectos de la GHRH en la liberación de GH .
La GH y el ejercicioLa GH es ampliamente manipulada y hasta utilizada abusivamente como sustancia anabólica mejoradora del rendimiento, por atletas y culturistas. Sin embargo, los efectos de la GH sobre la masa de músculos esqueléticos, la fuerza y la composición de fibras, permanecen poco claros.
Revisión de estudiosExisten numerosos estudios acerca de la GH y su rol en el ejercicio, como también mucha bibliografía escrita analizando dichas investigaciones.
Hay que tener en cuenta que el análisis de los estudios es complejo ya que se utilizan protocolos diferentes y sujetos de edades diversas.
Efecto de la administración de GH sola o combinada con entrenamiento en ejercicios de resistencia en adultos mayores sanos (Lange y col, 2002)
Protocolo: adultos (74+/- 1 años), se administró por 12 semanas con una concentración final de aproximadamente 7.2 +/- 0.8 microgramos/kg x día. Se midieron la fuerza isocinética y la potencia del cuádriceps, su área, la composición de este músculo en cuanto al tipo de fibra, tamaño y cantidad de cadena de miosina pesada (MHC), la composición corporal, y marcadores en suero relacionados con la GH
Conclusiones: Se observaron cambios en la composición corporal, disminución de la masa grasa, incremento de la masa magra y ausencia de cambios en la composición mineral de los huesos, sin embargo se reportó una alta incidencia de efectos secundarios, por lo que el estudio concluyó que la administración de GH cambia las isoformas de la cadena de miosina pesada (MHC) en el músculo esquelético, pero no aumenta la fuerza muscular o la hipertrofia, tanto sola o combinada con entrenamiento de resistencia en hombres sanos de edad avanzada
Wideman y col (2002) han mostrado que existe una relación lineal entre la magnitud del incremento de la liberación de GH y la intensidad del ejercicio. La cantidad de GH liberada es mayor en mujeres jóvenes que en hombres jóvenes y se encuentra reducida 4 a 7 veces en individuos de mayor edad en comparación con individuos más jóvenes.
Luego del incremento intenso de la secreción de GH asociada a una sesión de ejercicio aeróbico, la liberación de GH decrece transitoriamente.
Como la respuesta de GH a ejercicio de resistencia depende del intervalo descanso-trabajo, y de la carga y frecuencia del ejercicio utilizado, sería deseable poder comparar las intensidades de diferentes protocolos de ejercicios de resistencia, pero no es tarea fácil.
La disminución de la secreción de GH en individuos con más edad o que tienen obesidad, está asociado con muchos efectos deletéreos para la salud, sin embargo no a sido establecida una relación causa-efecto. A pesar de que el ejercicio no restituye los niveles de secreción de GH observados en individuos jóvenes y saludables, el ejercicio es un estímulo muy potente de secreción de GH. Tal vez en algunos casos sea necesaria la combinación del ejercicio con la administración oral de secretagogos de GH, sin embargo aún no se han establecidos los probables beneficios clínicos de dicha estrategia.
Otro estudio: Efectos de una única dosis de GH en la performance del ejercicio y el metabolismo durante el ejercicio de bicicleta moderado e intenso. Protocolo: se utilizó una suplementación de 7.5 UI (2.5mg) de GH o placebo (doble ciego, experimento cruzado). Conclusión: una única y gran dosis de GH causa incrementos exagerados en el lactato y la acción lipolítica combinada de la GH y el ejercicio, lo cuál se evidenció por el aumento de 3 veces en el glicerol y en los ácidos grasos no esterificados (NEFA, en inglés) en plasma, con respecto a los valores encontrados con el ejercicio sólo, sin embargo el incremento de sustratos no redundó en un incremento de la oxidación de grasas a nivel corporal (medido por calorimetría indirecta).
Este incremento excesivo de lactato en el plasma sanguíneo podría estar asociado con una disminución sustancial de la performance. (Lange, 2002).
Con la edad y la inmovilización se observa una declinación de la masa muscular esquelética y de la fuerza. Un estudio investigó los efectos de la combinación de ejercicio suave y GH (Andersen, 2000).
Protocolo: Estimulo de correr en cinta 8 m/min, 1h/día, suplemento de GH: 2.7mg/kg por día inyectada subcutáneamente y se estudió el efecto sobre la tensión tetánica de la musculatura, el peso magro seco, el volumen y las concentraciones de agua, grasa y colágeno, en ratas de edad avanzada.
Conclusión: la masa muscular aumentada inducida por GH + ejercicio suave, está asociada con un correspondiente incremento de la tensión tetánica máxima. Además la combinación de GH y ejercicio provocó un sustancial incremento adicional de la masa muscular y la tensión máxima (18% más), en comparación con las ratas que recibieron sólo GH
Raastad y col (2000) estudiaron la respuesta de GH a entrenamientos de fuerza de moderada y alta intensidad.
Protocolo: entrenamiento intenso: 3 repeticiones máximas al 100% de cada sujeto para sentadillas y 6 repeticiones máximas al 100% para extensiones de piernas.
En el entrenamiento moderado, la intensidad del trabajo fue del 70% del protocolo anterior. Se tomaron muestras cada 15min durante la primera hora post-ejercicio y luego 3, 7, 11, 22, y 33 hs luego del ejercicio.
Conclusión: Se observó que las respuestas de GH fueron semejantes en los dos protocolos, y se puso en evidencia una gran variación inter-individual en la respuesta de la hormona a ambos entrenamientos
Manetta y col (2002), estudiaron el efecto del entrenamiento sobre el eje GH/IGF-I durante el ejercicio en hombres de mediana edad, y su relación con la homeostasis de la glucosa.
Protocolo: hombres de mediana edad entrenados vs sedentarios
Compararon los niveles de GH, IGF-I, y las proteínas que se unen IGF, la (IGFBP)-1 e IGFBP-3, en respuesta a ejercicio de resistencia de larga duración (60min de bicicleta, por debajo y por encima del umbral ventilatorio. Conclusión: todos los parámetros basales fueron mayores en los individuos entrenados, durante el ejercicio por encima del umbral ventilatorio, los sujetos entrenados mostraron una respuesta 3 veces mayor de GH.
Estos datos sugieren que el entrenamiento de resistencia en los hombres de mediana edad incrementa la actividad del sistema GH/IGF-I y mejora la glucorregulación tanto en el reposo como durante el ejercicio de resistencia de alta intensidad.
Stokes y col (2002) estudiaron la respuesta de GH a sprints máximos de 6 s y 30 s en bicicleta ergométrica.
Conclusiones: las respuestas metabólicas fueron mayores luego del sprint de 30s; el promedio más alto medido de las concentraciones séricas de GH luego del sprint de 30s, fue más del 450% mayor que luego del de 6s.
La GH en suero también permaneció elevada por 90-120 min luego del sprint de 30s, en comparación con los 60 min luego del sprint de 6s. Hubo una gran variación entre los individuos en la respuesta de GH al sprint de 30s.
Estos datos sugerirían que la duración de una sesión de ejercicio de sprint máximo determina la magnitud de la respuesta de GH, sin embargo los mecanismos responsables aún permanecen esquivos
Consitt y col (2002) indagaron sobre las respuestas de las hormonas anabólicas endógenas al ejercicio de endurance vs el de resistencia con carga en mujeres.
Conclusiones: se encontró que los cambios hormonales luego de ambos tipos de entrenamiento han sido variables, probablemente por diferencias en los diseños experimentales y diferencias principalmente en la duración, intensidad y volumen de los programas de entrenamiento. Con la notable excepción de la GH, todas las demás hormonas anabólicas parecen decrecer con el entrenamiento de endurance. El ejercicio contra resistencia tiene un pequeño efecto en los niveles hormonales en reposo, con la excepción del factor de crecimiento semejante a la insulina (IGF-I), el cual ha sido demostrado que se ve aumentado luego de un programa de entrenamiento. Estos cambios hormonales potencialmente tienen tanto implicancias metabólicas como en la hipertrofia.
Sugimoto y col (2002) estudiaron el efecto del tratamiento con bajas dosis de GH sobre los marcadores de la composición corporal y el recambio óseo, la concentración de IGF-I y la densidad de masa ósea.
Protocolo: mujeres japonesas con osteoporosis, inyección subcutánea de 0.00595 mg/kg por día, por 48 semanas.
Conclusión: que el tratamiento con bajas dosis de GH atenúa la disminución de fuerza muscular y de la masa ósea en mujeres de edad avanzada sin efectos colaterales
GH, dieta y suplementación¿Puede la dieta introducir cambios en los patrones hormonales de GH?
Se estudio la relación entre una dieta restringida severamente en CHO, la intensidad del ejercicio (incremental, graduado) y las respuestas hormonales al mismo.
Protocolo: dos tipos de dietas isocalóricas: una baja en CHO (< 5% del contenido energético) y otra, mixta.
Conclusión: La restricción de CHO no afecta el patrón de cambios en la GH plasmática.
Por otra parte, se sabe que la suplementación con proteínas y CHO antes y después del entrenamiento puede alterar las respuestas hormonales y metabólicas al realizar un entrenamiento consecutivo de ejercicios con resistencia pesada (Langfort y col, 2001).
Kraemer (1998) estudió a sujetos suplementados por 1 semana, 2hs antes del entrenamiento e inmediatamente después, los cuales mostraron respuestas de GH y prolactina significativamente mayores
La acumulación de grasa abdominal particularmente reprime la liberación de GH.
Una investigación utilizó la administración de GH a adultos obesos para disminuir la grasa corporal total y especialmente la abdominal. Se observó que la suplementación con GH combinada con una restricción dietaria y/o ejercicio, parece provocar cambios favorables en la composición corporal (Weltman, 2001).
A pesar de que el ejercicio es un estímulo poderoso para la liberación de GH, la respuesta de GH al ejercicio se encuentra mitigada en individuos de mayor edad y en obesos. Esto sugiere que podrían ser necesarias sólo intensidades de ejercicio relativamente más altas para estimular la adecuada liberación de GH en los sujetos obesos.
En resumen, los datos sugieren que una combinación de GH con ejercicio regular y un programa estricto de alimentación podría proveer una estrategia tripartita para el manejo de una obesidad significativa.
Por último, un estudio exploró el efecto de la ingestión de una dosis única de 20g de creatina (Cr) sobre la secreción de GH. Para la mayoría de los sujetos, la concentración máxima de GH se encontró entre las 2 y 6 hs luego de la ingestión. Se concluyó que en condiciones de reposo y a altas dosis, la Cr incrementa la secreción de GH, simulando la respuesta a ejercicio intenso, que también estimula la secreción (Schedel, 2000)
Suplementación con aminoácidosActualmente se ha estado utilizando como estrategia la administración oral o intravenosa de aminoácidos específicos como arginina, lisina y ornitina, para estimular la liberación de GH. De hecho muchas personas consumen aminoácidos antes de rutinas de entrenamiento de la fuerza, creyendo que esta práctica acentúa la liberación de GH inducida por el ejercicio, y por lo tanto promoviendo una ganancia mayor de masa muscular y fuerza. Durante el ejercicio, la intensidad es el mayor determinante de la liberación de GH. Sin embargo hay que aclarar que la respuesta de la GH a la administración de aminoácidos posee un alto grado de variación interindividual, y puede ser alterada por las condiciones del entrenamiento, la edad, el sexo y la dieta.
A pesar de que un estudio ha mostrado que la administración intravenosa de arginina puede intensificar la respuesta de GH al ejercicio, no hay estudios hasta el momento que hayan encontrado que la suplementación oral pre-ejercicio con aminoácidos, aumente la liberación de GH.
¿Qué sucede con respecto a los niños y adolescentes?Si bien en adultos, el tratamiento con GH reduce la obesidad abdominal y mejora la sensibilidad a la insulina, así como también los perfiles de lípidos sanguíneos
Existen escasos estudios. La obesidad en la niñez está asociada con severas anormalidades en el eje de la GH, incluyendo la disminución de la secreción espontánea, de la respuesta a segretagogos exógenos y la alteración en el patrón pulsátil de la secreción.
En una investigación realizada en niños prepúberes severamente obesos tratados con GH durante 12 meses, sin modificaciones dietarias ni ejercicio, se observó una disminución de 5% en el porcentaje de grasa corporal, posiblemente vía la estimulación de la lipólisis inducida por catecolaminas, sin efectos negativos sobre la homeostasis de la glucosa (Kamel, 2000).
Bibiliografía
Andersen NB et al. "Growth hormone and mild exercise in combination increases markedly muscle mass and tetanic tension in old rats". Eur J Endocrinol. 2000;143(3):409-18.
Consitt LA et al. "Endogenous anabolic hormone responses to endurance versus resistance exercise and training in women". Sports Med. 2002;32(1):1-22. Review.
"Fundamental Neuroscience". Editado por M. Zigmond y col. Academic Press, 1999.
Grounds MD. "Reasons for the degeneration of ageing skeltal muscle a central role for IGF-1 signalling".. Biogerontology (2002) 3: 19-24.
Jenkins PJ. "Growth hormone and exercise: physiology, use and abuse". Growth Hormone and IGF Research (2001)11 Suppl:S71-7.
Kamel A et al. "Effects of growth hormone treatment in obese prepubertal boys". J Clin Endocrinol Metab. 2000;85(4):1412-9
Kraemer WJ et al. "Hormonal responses to consecutive days of heavy-resistance exercise with or without nutritional supplementation". J Appl Physiol. 1998;85(4):1544-55.
Lange KH et al. "GH administration changes myosin heavy chain isoforms in skeletal muscle but does not augment muscle strength or hypertrophy, either alone or combined with resistance exercise training in healthy elderly men. J Clin Endocrinol Metab. 2002;87(2):513-23.
Lange KH et al. "Acute growth hormone administration causes exaggerated increases in plasma lactate and glycerol during moderate to high intensity bicycling in trained young men". J Clin Endocrinol Metab. 2002;87(11):4966-75.
Langfort JL et al. "The effect of low-carbohydrate diet on the pattern of hormonal changes during incremental, graded exercise in young men". Int J Sport Nutr Exerc Metab. 2001;11(2):248-57.
Manetta J et al. "Effect of training on the GH/IGF-I axis during exercise in middle-aged men: relationship to glucose homeostasis". Am J Physiol Endocrinol Metab. 2002;283(5):E929-36.
Raastad T et al. "Hormonal responses to high- and moderate-intensity strength exercise". Eur J Appl Physiol. 2000;82(1-2):121-8.
Schedel JM et al. "Acute creatine loading enhances human growth hormone secretion". J Sports Med Phys Fitness. 2000;40(4):336-42.
Sonksen PH. "Hormones and sport. Insulin, growth hormone and sport". Journal of Endocrinology (2001) 170:13-25.
Stokes CA et al. "The time course of the human growth hormone response to a 6 s and a 30 s cycle ergometer sprint". J Sports Sci. 2002;20(6):487-94
Sugimoto T et al. "Effect of low-dose of recombinant human growth hormone on bone metabolism in elderly women with osteoporosis". Eur J Endocrinol. 2002;147(3):339-48.
Van Cauter E and Copinschi G. "Interrelationships between growth hormones and sleep". Growth Hormone and IGF Research (2000) 10 (Suppl B) S57-S62.
Wallace JD et al. "Responses of the growth hormone (GH) and insulin-like growth factor axis to exercise, GH administration, and GH withdrawal in trained adult males: a potential test for GH abuse in sport. Journal of Clinical Endocrinology and Metabolism (1999) 84: 3591-3601.
Weltman A et al. "Body composition, physical exercise, growth hormone and obesity". Eat Weight Disord. 2001;6(3 Suppl):28-37. Review.
Wideman L et al. "Growth hormone release during acute and chronic aerobic and resistance exercise: recent findings". Sports Med. 2002;32(15):987-1004. Review.
| |
|
|---|---|
|
revista
digital · Año 9 · N° 62 | Buenos Aires, Julio 2003 |
|