Dopaje genético es un método de alteración de genes de manera que estos
actúen diferente de su comportamiento innato. El objetivo final es la mejora
del rendimiento deportivo.
Desventajas
del dopaje actual
-
La
inyección y/o ingestión de hormonas tiene un efecto relativamente corto.
-
Se
requiere tratamiento en forma frecuente (Por ejemplo con EPO y/o EA).
-
Los
controles antidopaje son mas estrictos y avanzados. Además se realizan
exámenes fuera de las competiciones y sin previo aviso.
Inyectar a una persona con un gen (DNA) resultaría en beneficios de largo
plazo.
¿Cómo
se realizaría el dopaje genético?
Se utilizan técnicas desarrolladas para terapia genética.
-
La
manera mas común se conoce como “viral vector” donde un vehículo de
distribución que no causa una patología y contiene el gen que nos
interesa, puede ser desarrollado para inyectarlo en un tipo específico de
tejido.
-
En
el tratamiento de mejora muscular, el virus es inyectado directamente dentro
del tejido muscular donde infecta los núcleos de las células musculares
replicando el gen y, finalmente, incrementando la masa muscular.
Terapia
genética
Es la introducción de material genético dentro de las células por motivos
terapéuticos.
Muchas de las enfermedades humanas son causadas por la ausencia y/o presencia
inadecuada de una proteína.
-
Biotecnólogos
fueron capaces de aislar y producir proteínas naturales a través de
procesos propios de la ingeniería genética y la tecnología recombinante.
-
La
terapia genética es el método elegido de distribución de las proteínas,
en donde los genes distribuidos entran en los cuerpos celulares y los
convierten en pequeños centros productores de proteínas específicas por
un prolongado período de tiempo.
Genes
a considerar para dopaje genético
-
Erythropoietin (EPO)
-
Insulin-like growth factor (IGF-1)
-
Myostatin gene
-
PPAR-Delta
-
Otros
EPO
EPO es
una hormona producida en los riñones que regula la producción de células
sanguíneas rojas (RBCs).
Datos
experimentales
Conclusiones
Riesgos
de terapia genética incluyen:
-
Sobre-expresión del gen y/o
-
Una respuesta inmunológica agresiva.
Dopaje
genético – IGF-1 y miostatina
Cuando
el tejido muscular es dañado, como por ejemplo durante el ejercicio intenso y/o
prolongado, las células satélite proliferan alrededor de la zona afectada para
colaborar en el proceso de reparación de las fibras musculares. Las fibras
musculares reparadas son más gruesas y fuertes.
-
IGF-1
parcialmente controla la reparación del músculo a través de la proliferación
de células satelitales.
-
IGF-1
Parcialmente regula la reparación muscular a través de la estimulación y
proliferación de células musculares
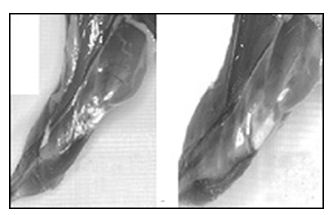
Comparación
de los músculos de las piernas de dos ratones. Derecha con tratamiento de
IGF-1, Izquierda sin tratamiento
Dopaje
genético – PPAR-delta
“Marathon
mouse”: Un equipo de científicos de Estados Unidos y Corea del Sur han creado
lo que llaman “marathon mouse”. Este ratón le fue administrado una forma
mejorada del gen PPAR-Delta. Este gen regula la expresión de varios otros genes
y estimula las fibras musculares de acción lenta. Estas son las fibras
musculares esqueléticas que son más resistentes a la fatiga.
Los
científicos encontraron que el ratón de ingeniería genética podía:
-
Correr casi dos veces mas distancia que un ratón normal
-
Podían correr aproximadamente una hora más que los 90 minutos que un
ratón entrenado es capas de correr.
-
El ratón entrenado experimentó un incremento de las fibras musculares
de contracción lenta y un descenso de las fibras musculares de
contracción rápida como así también un acelerado proceso de
movilización de las grasas en los tejidos adiposos.
Este
gen podría ser usado no solo en mejorar la calidad muscular sino también en
pérdida de peso.
-
Los ratones tratados resistían cualquier ganancia de peso, inclusive
cuando fueron puestos en una dieta rica en grasas y alta en calorías
que hizo a los ratones control volverse obesos.
-
Para individuos obesos, que tienen dificultad para perder peso y cuya
salud se vea comprometida como resultado de esto, estas investigaciones
podrían significar en un nuevo método para tratar este tipo de
patologías.
Los
atletas de deportes de resistencia se beneficiarían ya que podrían “hacer la
actividad física más eficiente” y ayudarlos a incrementar la resistencia en
forma más rápida.
Conclusiones
Ventajas
-
Cura de enfermedades hereditarias (CF, DMD, etc.).
-
Ayudar en el tratamiento de enfermedades no hereditarias (cáncer, etc.).
-
Mejorar la condición física y deportiva.
Desventajas
-
No hay “human trials” que hayan resultado exitosos hasta la fecha.
-
Genes que agrandan los músculos podrían afectar el corazón, los
tendones y los huesos.
-
La sobreexpresión de un gen puede ser muy peligrosa.
-
La respuesta inmune puede detonarse si un nuevo gen es introducido.
-
Genes sintéticos podrían llegar a ser detectados a través de “DNA
screens”.
Dificultades
de la terapia genética
-
El Dr. Wilson de la Universidad de Pensilvania lideró uno de los primeros
estudios con terapia genética aplicada a humanos en un esfuerzo por
introducir genes para curar cystic fibrosis. En 1999 se encontró en medio
de un desastre. Jesse Gelsinger, de 18 anos de edad, con una enfermedad rara
del hígado estaba enlistado en uno de los “trials” clínicos del Dr.
Wilson. Jesse recibió una inyección de material genético que su cuerpo
rechazó. Cuatro días después estaba muerto.
-
A pesar de lo sucedido, Wilson y otros científicos siguieron adelante. Ha
habido mas de 1.000 “gene therapy clinical trials” en todo el mundo y
este campo de la medicina es uno de los que hay mayores perspectivas en la
lucha contra enfermedades como el diabetes y el mal de Parkinson, entre
otras.
-
El problema principal es que la interacción entre genes sigue siendo poco
entendida y los genes administrados no siempre se ubican en el lugar donde
los científicos desean o intentan.
-
En humanos, el éxito ha sido limitado. El ejemplo mas citado es el del
tratamiento de una enfermedad fatal conocida como X-linked SCID o
"bubble boy disease" en 10 chicos en Francia, Ocho de los cuales
se recuperaron. Los otros dos desarrollaron Leucemia luego que los nuevos
genes se ubicaran en un lugar peligroso.
-
Puede llevar décadas hasta que terapias viables estén disponibles. La
mayoría de los intentos/experimentos que utilizan humanos se hacen con
pacientes terminales.
Bibliografía
-
Cazzola, M. (2000). A global strategy for prevention and detection of blood
doping with erythropoietin and related drugs. Haematologica, 85:561-3.
-
Joyner, M. (2002). News brief: altitude training, erythropoietin, and blood
doping. Exercise Sports Science Review, 3:97-8.
-
Joyner, M. (2003). VO2 max, blood doping, and erythropoietin. British Journal
of Sports Medicine, 37:190-191.
-
Kristof, N. (2004).
Building better bodies. Retrieved June 20, 2007, from http://www.nytimes.com/
-
Smith, G. (2004). Researchers cite dangers of gene doping in sports.
Retrieved
June 20, 2007, from http://www.boston.com/.
-
Unal, U., & Ozer Unal, D. (2004). Gene doping in sports.
Sports Medicine,
34(6) 357-362.
-
Wilborn, C., & Willoughby, D. (2004). The role of dietary protein intake and
resistance training on myosin heavy chain expression. Journal of the
International Society of Sports Nutrition, 1(2):27-34.
Otros artículos sobre
Actividad Física y Salud
 |
|
|
EFDeportes.com, Revista
Digital · Año 17 · N° 174 | Buenos Aires,
Noviembre de 2012
© 1997-2012 Derechos reservados
|


