
|
|||
|---|---|---|---|
|
|
Moléculas
inducidas por los estímulos de hipoxia y su repercusión |
|
|
|
Asesoramiento Científico-Técnico para el Entrenamiento Deportivo Unidad de Hipoxia Intermitente y Fisiología del Deporte. Centro K2. Vitoria-Gasteiz. Facultad de Ciencias de Actividad Física y el Deporte. Departamento de Educación Física y el Deporte. Universidad del País Vasco / Euskal Herriko Unibertsitatea (UPV-EHU) |
Aritz Urdampilleta Otegui (España) |
|
|
|
Resumen Estados hipóxicos y la expresión de HIF-1 y los genes que regula, se han relacionado con múltiples circunstancias ambientales y fisiológicas, así como en altitud, ejercicio físico intenso, frío, exposición al tabaco y procesos fisiopatológicos. La importancia reside en conocer la situación hipóxica que moléculas induce y cuáles son las respuestas esperadas ante esas situaciones para potenciar o intentar inhibir sus efectos moleculares y fisiológicos. El factor HIF-1, factor endotelial y vasodilatadores, así como la eritropoyetina (EPO) tienen efectos beneficiosos en el rendimiento deportivo y salud del deportista. Por otra parte, estas moléculas en el sistema cardiovascular y sistema nervioso tienen efectos beneficiosos, pueden tener efectos indeseables en otros procesos patológicos y se debería de controlar su respuesta. Palabras clave: Hipoxia. Actividad física. Moléculas inducidas. HIF-1. VEGF. EPO.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires, Año 17, Nº 172, Septiembre de 2012. http://www.efdeportes.com/ |
|
|
1 / 1
Introducción
La fisiopatología es un territorio de límites imprecisos, que tiene como denominador común la adaptación a la enfermedad de mecanismos que, en su origen, se desarrollaron para responder a situaciones de especial exigencia en individuos sanos. Así, entre otras, el organismo enfermo emplea respuestas sistémicas primarias ante la agresión, como las que se desencadenan ante la pérdida de sangre, la infección, los traumatismos, la deshidratación, el ayuno, o la hipoxia, para hacer frente a situaciones patológicas.
Como ejemplos característicos entre las respuestas fisiológicas ante situaciones de agresión y sus efectos beneficiosos y malignos en situaciones fisiopatológicas, podemos considerar por ejemplo: 1) la estimulación del eje reninaangiotensina-aldosterona incluye aspectos inflamatorios y promotores de la cicatrización vascular, que son útiles en el caso de la herida de un vaso, pero resultan deletéreos en la arteriosclerosis crónica; o 2) el remodelado vascular pulmonar inducido por la hipoxia es necesario y favorable en la adaptación fisiológica a la altitud o en los entrenamientos en hipoxia, pero actúa negativamente en un paciente con enfermedad pulmonar crónica, como sucede en muchos andinos que viven a altitudes elevadas y no han adquirido adaptaciones a la altitud como los tibetanos.
La hipoxia tiene un paradigma de respuestas que involucran al organismo en su conjunto y pueden tener consecuencias diferentes, por ejemplo de mejora en el deporte y salud y peligros en ciertas enfermedades como sucede en el cáncer.
La respuesta a las situaciones hipóxicas
La respuesta a la hipoxia puede esquematizarse en tres sistemas diferentes, las que explicaremos esquemáticamente a continuación:
-
Detección o sensor de oxígeno.
-
Regulación, mediante el control de la expresión de una amplia serie de genes. El sistema regulador está modulado directamente por el sensor y el elemento organizador principal es un factor de transcripción específico, el factor inducible por hipoxia 1 (HIF-1).
-
Efector múltiple, que incluye no sólo expresión de genes, sino múltiples cambios funcionales, que van desde la estimulación de moléculas vasodilatadoras hasta las variaciones en la afinidad de la hemoglobina por el oxígeno.
Todos los organismos, desde las bacterias hasta los humanos, poseen mecanismos para el mantenimiento de la homeostasis del oxígeno, que son esenciales para la producción energética y por lo tanto para la supervivencia. En los mamíferos superiores, la respuesta a la hipoxia es compleja, e incluye, entre otras, adaptaciones de la función respiratoria y hemodinámica, del metabolismo intermedio y de la función renal. Estas adaptaciones se manifiestan en cambios hormonales, de mediadores y de actividad enzimática, e implican variaciones en la expresión de una serie de genes entre los que destacaremos el factor de crecimiento del endotelio vascular (VEGF) y la eritropoyetina (EPO).
El estímulo hipóxico da lugar a un aumento en los niveles del factor Inducible a la Hipoxia (HIF-1), ya que en estas condiciones la destrucción de la molécula se ve disminuida, ya que en normoxia se destruye constantemente. Así, esta disminución en la eliminación debido a la hipoxia, y no el aumento en la producción de HIF-1 es lo que da lugar a su incremento.
El HIF-1 actúa como el regulador principal en la expresión de los diferentes genes regulados por el oxígeno, y en este momento son más de 2 docenas los genes regulados por el HIF-1; sin embargo, parece que pueden ser muchos más, y será la evolución de la investigación y del conocimiento lo que nos irá permitiendo conocer más en profundidad todas las funciones del HIF-1 y por tanto todas las repercusiones del influjo hipóxico. Como norma general, las moléculas más estudiadas inducidas por el HIF-1 son el factor endotelial (VEGF) o la eritropoyetina (EPO), las dos de gran trascendencia en contextos fisiopatológicos así como en el contexto deportivo. Vamos a analizarlos cada una de ellas a continuación.
Moléculas inducidos por la hipoxia
(Hipoxia Inducible Factor)Factor HIF-1
En el presente apartado nos centraremos específicamente en el factor HIF-1, ya que vemos que tiene múltiples aplicaciones en diferentes estados fisiológicos como fisiopatológicos.
Se han realizado numerosos estudios acerca de la cascada de señalización intramolecular en respuesta a la deficiencia de oxigeno, y otros muchos puntos que todavía se desconocen. Una de las moléculas más importantes es el factor de trascripción HIF-1 (Hipoxia Induce Factor). Esta proteína funciona como reguladora clave en las condiciones de baja condiciones de disponibilidad de oxigeno celular, regulación de la expresión de una serie de genes relacionados en la homeostasis de este gas (Semenza, 2002).
Los niveles de HIF-1 aumentan exponencialmente cuando disminuye la concentración de oxígeno a nivel tisular. Es decir, una normal concentración de O2 en un tejido, e incluso un aumento significativo de dicha concentración no van a dar lugar a variaciones en la concentración de HIF-1, pero una ligera disminución de la concentración de O2 tisular va a dar lugar a un aumento muy importante (no es una elevación lineal, sino exponencial) de la concentración de HIF-1, y con ello cambios en casaca por estimulación de los genes regulados por el HIF-1 y sus efectos posteriores. En la actividad física intensa (anaeróbica), anemia o pérdidas de sangre podemos observar aumentos elevados del Factor HIF-1.
El factor HIF-1 se une a unas determinadas secuencias de más de 70 genes de manera directa y más de 200 genes de manera indirecta, con tal de estimular la producción de proteínas codificadas por esta (Werger, 2006). Estas proteínas están involucrados en diferentes procesos importantes como podrían ser: angiogénesis (generación de nuevos vasos capilares), eritropoyesis, trasporte de glucosa, transporte de hierro, activación de la glucólisis, proliferación y viabilidad celular, remodelación vascular, respuestas vasomotoras… entre otras (Werger, 2006). Con estos no nos extrañamos de sus importancia en ciertos estados fisiológicos como fisiopatológicos.
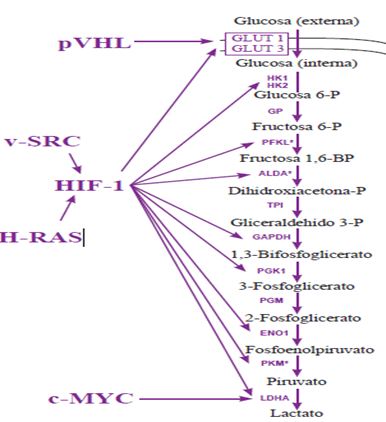
Figura 1. Implicación de factor HIF-1 en las rutas metabólicas glucolíticas (González, 2007).
Factor endothelial VEGF (Vascular Endotelial Growth Factor)
Uno de los genes diana que en los procesos de hipoxia es el gen del VEGF. Este factor, como su nombre indica, provoca la formación de nuevos vasos sanguíneos y capilares (proceso conocido como angiogénesis) y aumenta la descarga de oxigeno a los tejidos (Carmeliet, 2005).
En los procesos cancerigenos se produce este fenómeno en mayor medida, ya que en el crecimiento de la masa tumoral es necesaria la aparición de nuevos vasos sanguíneos. Por este motivo, se piensa que la inhibición en la primera instancia del VEGF puede provocar en definitiva la parada de la angiogénesis como posible terapia anticancerígena (Ferrara, 2005).
Otros estudios demuestran que la combinación de quimioterapia e inhibidores de la angiogénesis mejora el tratamiento tumoral y aumento de la supervivencia en las enfermedades (Ferrara y Kerbel, 2005). No obstante todas estas iniciativas, encaran que falta mucho para estudiar acerca de este mecanismo en ciertas patologías, ya que no se informa de forma adecuada acerca de: la dosis, duración del tratamiento, monitoreo del tratamiento entre otros factores importantes para buscar un tratamiento óptimo.
Por otra parte, en el sentido opuesto, hay otros estudios que dicen que la angiogénesis puede solucionar totalmente o parcialmente, posibles isquemias, infartos o otras patologías que desencadenan o provocan una mala perfusión, y así con el factor endotelial se podría conseguir que estas zonas con mala perfusión estuvieran mejor irrigadas. Esta situación en la rehabilitación cardiaca resulta muy interesante y es más se ha observado que los estímulos de hipoxia intermitente pueden ayudar en la rehabilitación cardiaca.
Estos podría ser una de las alternativas para ciertas patologías, ya que en determinadas ocasiones no hay procedimientos de reconstrucción quirúrgica (Tateichi-Yuyama y cols, 2002).
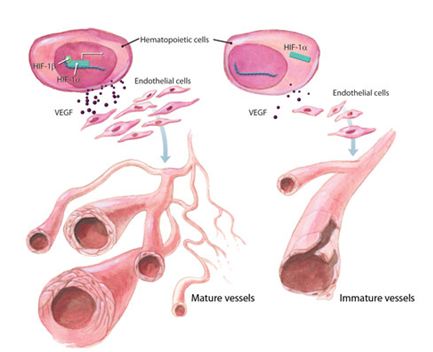
Figura 2. VEGF inducido por el factor HIF. Acción sobre las células endoteliales (www.rndsystems.com/DAM_public/5940.jpg).
Eritropoyetina (EPO)
Otro de los genes estimulados por el HIF-1 es la eritropoyetina (EPO). Esta hormona glucoproteica renal estimula la síntesis en la médula ósea de nuevos reticulocitos, precusores de eritrocitos. En el último termino aumenta la aportación de oxigeno a nivel sistémico.
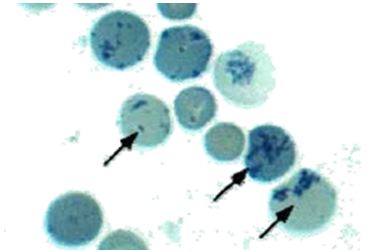
Figura 3. Reticulocitos nuevos (señalados con un cuadro), paso de eritroblasto a hematíe. El punteado se debe a que restos de ARN (del núcleo del eritroblasto)
precipitan con ciertos colorantes vitales como el azul de metileno o el azul brillante de cresil. La cantidad de precipitado va disminuyendo al ir madurando el reticulocito
La eritropoyetina es una hormona glucoproteica cuya función principal, que no única, es la regulación de la producción de glóbulos rojos de la sangre y con ello todos los procesos relacionados con la formación de energía por vía aeróbica.
Esta función tan importante para el mantenimiento de la vida y del bienestar, es lo que ha dado lugar a un gran desarrollo en el conocimiento de la EPO y a que desde hace tiempo se haya conseguido sintetizarla mediante técnicas recombinantes.
A la vez, cabe decir que estados de anemia y la pérdida de sangre (procesos que podemos observar en contextos deportivos) también provoca la secreción de EPO.
Aun así, todos los esfuerzos realizados para conocer en profundidad los procesos de síntesis y regulación, así como los efectos de la EPO no han tenido en todos sus casos resultados definitivos. Todavía existen lagunas de conocimiento cuando nos referimos a esta hormona, y en los últimos tiempos hemos conocido importantes avances en su regulación a través del Factor Inducible por la Hipoxia (HIF), y en sus funciones aparte de la estimulación de la formación de eritrocitos.
Por otra parte, decir que la síntesis de los glóbulos rojos no es la única función de la EPO, ya que también han descubierto que tiene efectos en tejidos no hematopoyéticos, como por ejemplo el sistema nervioso central (SNC), que a la vez tendría un efecto neuroprotector preveniendo la muerte de las neuronas por el estímulo hipóxico o del glutamato (Siren y Ehrenreich, 2001).
De la misma manera existen receptores de la EPO en los cardiomiocitos que también podrían participar en la función protectora del miocardio. Respecto a la acción de la EPO en los vasos sanguíneos, estimula la angiogénesis y la producción del factor endotelial (VEGF), endotelina, así como otros mediadores vasoactivos.
La EPO presenta un ciclo circadiano, y los valores máximos suelen darse entre las 16:00 y las 22:00 de la tarde-noche, y los valores mínimos a las primeras horas de la mañana.
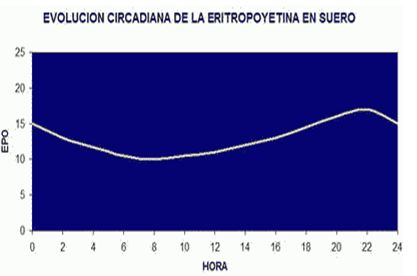
Figura 4. Ritmo circadiano de la eritropoyetina (www.biolaster.com)
Repercusión en las situaciones fisiopatológicas y el deporte
Sintetizando los apartados anteriores la respuesta de HIF-1 y en consecuencia el VEGF o EPO es específica de la hipoxia y del tipo de estímulo por factores de crecimiento. Así, se relaciona con la necesidad de proveer una mayor oferta de oxígeno en tejidos en expansión celular. En este punto cabe preguntarse si la célula en diferentes situaciones fisiopatológicas responde a la depleción energética de forma idéntica a la falta de oxígeno, tal como sucede en el caso del deporte de alta intensidad (anaerobiosis).
Actividad físico deportiva y el deporte
En este caso el déficit de ATP celular podría interpretarse como equivalente a situaciones de hipoxia celular, pero las investigaciones indican que esta situación no tiene efectos directo en el factor HIF-1 y en consecuencia los efectos de la hipoxia y déficit energética no son iguales, lo cual los deportes de resistencia de larga duración no deberían de activar esta cascada del factor HIF-1, sí en cambio los ejercicios de alta intensidad, porque se da un estado de hipoxia en las células activadas.

Figura 5. Los deportes anaeróbicos producen una situación de hipoxia y en consecuencia se activa la cascada del factor HIF-1. No sucede lo
mismo en deportes de resistencia de larga duración, y en consecuencia no se activarán las moléculas inducidas por la hipoxia en la misma medida
Tal como anteriormente hemos comentado, el HIF-1 es esencial en la inducción fisiológica del gen de EPO. Viendo esta relación desde el punto de vista del mecanismo global desarrollado anteriormente, es notable que HIF-1 actúe sobre al menos tres genes de importancia en cuanto al efecto de la EPO: 1) el de la transferrina, necesario para la oferta de hierro a las células eritroides, 2) el del VEGF, cofactor en la estimulación de estas mismas células y 3) el del oxido nítrico sintetasa (ONS), necesario para la producción de oxido nítrico (ON) (vasodilatador), que permite el mantenimiento de cifras normales de presión arterial durante el efecto de la EPO.
La importancia del ON en contextos deportivos, así como en la salud general parece ser muy importante, ya que en las investigaciones realizadas en ratones transgénicos para EPO humana, la inhibición de ONS provoca la muerte por complicaciones masivas cardiovasculares (Eckardt, 2001).
El mecanismo exacto por el cual aumenta la EPO en la estados anémicos graves no se ha dilucidado por completo; por ejemplo, en las Unidades de Cuidados Intensivos (UCI), los niveles de EPO son muy bajos para el grado de anemia; entre las razones de esto puede ser un inapropiado funcionamiento renal y en consecuencia una inapropiada producción de EPO (Fink, 2004). Esto no debería de suceder, cuando el funcionamiento renal es adecuada, ya que la situación anémica de por si, estimularía el factor HIF-1 y en consecuencia la EPO.
En el contexto deportivo, suele ser habitual encontrar valores bajos de hemoglobina por dl de sangre y un estado pseudoanémico pero no es la suficiente para encontrar aumentos significativos en la EPO.
En el contexto deportivo, los estímulos de hipoxia intermitente pasiva o activa, aumentan los niveles de EPO, según la carga hipóxica más o menos. Normalmente después de exposiciones hipóxicas de 1-2 horas, inducen secreciones máximas de EPO a las 6-10 horas y luego los valores de EPO caen en picada.
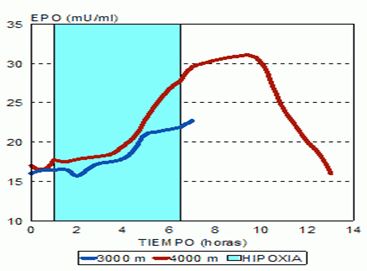
Figura 6. Evolución de los niveles de EPO según las altitudes simuladas mediante estímulos de hipoxia intermitente normobárica (www.biolaster.com)
En los entrenamientos en altitud, los valores de EPO en los primeros días de estancia en altitudes superiores a los 3000 metros se mantienen elevado y en estancias entre 21-28 días, se han observado aumentos significativos en la cantidad de glóbulos rojos y cantidad de hemoglobina (Stray-Gundersen et al, 2001). Esto junto a la expansión sanguínea que sucede con los entrenamientos de resistencia de larga duración, hace que el deportista tenga más cantidad de glóbulos rojos, más cantidad de volumen plasmático y en consecuencia mayor disponibilidad de oxigeno y nutrientes a los músculos activos y en consecuencia mayor rendimiento deportivo en deportes de larga duración.
De la misma manera, en situaciones de hipoxia se estimulan los vasodilatadores (oxido nítrico, endotelina…) y el factor VEGF y esto hace que haya una mayor vasodilatación, siendo beneficioso para la mejora del rendimiento deportivo.
Situaciones fisiopatológicas
Respectos a las situaciones fisiopatológicas, decir que se ha estudiado el factor HIF-1 ante enfermedades como: enfermedad pulmonar crónica, patología tumoral, shock hemorrágico, situaciones de anemia, ictus, enfermedad cardiaca, enfermedad inflamatoria intestinal.
A modo de ejemplo, en experimentos en ratón y humanos, se han observado que episodios breves de hipoxia intermitente bastan para inducir la producción de EPO, que a su vez protege al corazón. Por lo contrario, en los animales modelo que no expresan el factor HIF-1, no producen la EPO y tampoco se da una protección del corazón.
La sobreespersión de HIF-1 protege el epitelio colónico ante los procesos de inflamación que se dan en la enfermedad inflamatoria intestinal, lo cual -aunque aún se necesitan más estudios-, parece que los estímulos de hipoxia son beneficiosos para la colitis ulcerosa.
No obstante en los procesos tumorales, el factor HIF-1 se aumenta considerablemente y este estado se relaciona con una mayor agresividad del tumor. El factor HIF-1 al aumentarse y en consecuencia el VEGF hace que se de un proceso de angiogénesis y un mayor aporte de sangre para el tumor es perjudicial para hacer frente el organismo al tumor, dándose una proliferación tumoral mayor.
Otras situaciones
De la misma manera se han estudiado situaciones como: crecimiento intrauterino tardío o preemclamsia, efectos del tabaco-humo o efectos de ciertos fármacos y sobredosis.
Figura 7. Ante el humo del tabaco y sobredosis de fármacos el factor HIF-1 actúa de diferente manera. Ante el monóxido de carbono del tabaco se desestabiliza
el factor HIF-1, no obstante ante productos tóxicos y ciertos fármacos el factor HIF-1 estimula el citocromo P-450 ayudando la eliminación de estos
La hipoxia a través del factor HIF-1, estimula el citocromo P-450 influyendo en la capacidad de neutralización y eliminación de ciertos fármacos y productos tóxicos (Fradette, 2004).
Por otra parte, la exposición al humo del tabaco reduce la angiogénesis inducida por hipoxia, disminuyendo la expresión de VEGF y HIF-1α, a través de una desestabilización de HIF-1α por el monóxido de carbono (CO) producido en la combustión del cigarrillo.
Conclusiones generales
-
Estados hipoxicos y la expresión de HIF-1 y los genes que regula, se han relacionado con múltiples circunstancias ambientales y fisiológicas, así como en altitud, ejercicio físico intenso, frío, exposición al tabaco y procesos patológicos como el cáncer.
-
Es importante conocer la situación hipóxica que moléculas induce y cuáles son las respuestas esperadas ante esas situaciones para potenciar o intentar inhibir sus efectos moleculares y fisiológicos.
-
En contextos deportivos un aumento del factor HIF-1, vasodilatadores (endotelina, oxido nítrico…) o la misma EPO es indudablemente beneficioso, cosa que se consigue con entrenamientos en altitud o exposiciones en hipoxia intermitente. Lo mismo sucede en la rehabilitación cardiaca o afectaciones a nivel sistema nervioso.
-
En procesos tumorales, a lo contrario, nos interesa inhibir el factor HIF-1 las moléculas indirectamente involucradas, el VEGF y EPO.
Referencias bibliográficas
-
Carmeliet P. Angiogenesis in life, disease and medicine. Nature 2005; 438:932-36.
-
Eckardt KU. Anaemia in end-stage renal disease: pathophysiological considerations. Nephrol Dial Transplant 2001; 16 Suppl 7: 2-8.
-
Ferrara N. Molecular and biological properties of vascular endothelial growth factor. J Mol Med 1999; 77: 527-43.
-
Ferrara N, Kerber RS. Angiogenesis as a therapeutic target. Nature 2005; 438: 967-74.
-
Fradette C, Du SP. Effect of hypoxia on cytochrome P450 activity and expression. Curr Drug Metab 2004; 5: 257-71.
-
Fink MP. Pathophysiology of intensive care unit-acquired anemia. Crit Care 2004; 8 (Suppl 2): S9-10.
-
Hoppeler H, Vogt M, Weibel ER, Fluck M. Response of skeletal muscle mitochondria to hypoxia. Exp Physiol 2003; 88: 109-19.
-
Maxwell P, Salnikow K. HIF-1: an oxygen and metal responsive transcription factor. Cancer Biol Ther 2004; 3: 29-35.
-
Semenza GL, Nejfelt MK, Chi SM, Antonarakis SE. Hypoxia-inducible nuclear factors bind to an enhancer element located 3' to the human erythropoietin gene. Proc Natl Acad Sci USA 1991; 88: 5680-4.
-
Semenza GL. Oxygen-regulated transcription factors and their role in pulmonary disease. Respir Res 2000; 1: 159-62.
-
Semenza GL. Intratumoral hypoxia, radiation resistance, and HIF-1. Cancer Cell 2004; 5: 405-6.
-
Siren AL, Echrenreih H. Erytropoietin-a novel concept for neuroprotection. Eur Arch Psychiatry Clin Neurosc 2001;251.179-84.
-
Stray-Gundersen J, Chapman R, Levine B. “Living high-training low” altitude improves sea level performance in male and female elite runners. J Appl Physiol 2001;91:1113-20.
-
Tateishi-Yuyama E, Matxubara H, Murohara T, Ikeda U, Shintani S, Masaki H.et al. Therapeutic angiogenesis for patient with limb ischaemia by autologous transpalnatation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet 2002;360:427-35.
-
Werger RH, Gassmann M. Oxigen and the hypoxia-inducible factor-1. Biol Chem 1997;378:609-616.
-
Wenger RH. Mitochondria: oxygen sinks rather than sensors? Medical Hypoteses 2006;66:380-3.
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista
Digital · Año 17 · N° 172 | Buenos Aires,
Septiembre de 2012 |
|