
|
|||
|---|---|---|---|
|
|
O papel do cálcio nos eventos de contração e desencadeamento de lesões musculares El papel del calcio en la contracción y en la activación de lesiones musculares The role of calcium in the contraction and events triggering muscle injury |
|
|
|
*Doutor em Biologia Funcional e Molecular, Departamento de Bioquímica Instituto de Biologia, Universidade Estadual de Campinas, UNICAMP **Professor doutor da Faculdade de Educação Física, Departamento de Estudos da Atividade Física Aplicada, Universidade Estadual de Campinas, UNICAMP |
Joaquim Maria Ferreira Antunes Neto* Roberto Vilarta** (Brasil) |
|
|
|
Resumo A concentração de cálcio (Ca2+) mostra ser uma condição delimitadora para a manutenção da homeostasia celular. Sua ação nos processos de ativação dos eventos de contração muscular é decisiva, bem como para determinar o desacoplamento do conjunto actina-miosina. A integridade celular também é dependente do funcionamento correto do retículo sarcoplasmático, local onde o cálcio é armazenado. Alterações tanto da estrutura do retículo sarcoplasmático quanto da concentração ótima do cálcio podem induzir desorganização de estruturas importantes no processo de contração muscular. Unitermos: Cálcio. Retículo sarcoplasmático. Contração muscular. Lesões celulares.
Abstract The concentration of calcium (Ca2+) proves to be a boundary condition for the maintenance of cellular homeostasis. Its action in the activation processes of the muscle contraction events is critical, as well as to determine the decoupling of the action-myosin assembly. The cellular integrity is also dependent on the proper functioning of the sarcoplasmatic reticulum, where calcium is stored. Changes both the structure of the sarcoplasmatic reticulum and the optimum concentration of calcium can lead to disruption of important structures in the process of muscle contraction. Keywords: Calcium. Sarcoplasmatic reticulum. Muscle contraction. Muscle damage.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires - Año 17 - Nº 169 - Junio de 2012. http://www.efdeportes.com/ |
|
|
1 / 1
Introdução
O cálcio (Ca2+) desempenha papel determinante em muitas das atividades desenvolvidas pela membrana e em outras estruturas da célula: atua na ativação da fosforilação oxidativa, no auxílio à manutenção da integridade sarcolemal e, principalmente, na ativação das proteínas contráteis (Hansford, 1994). A sua ação nos eventos da contração muscular é o fator regulatório desde o momento gerador do potencial de ação até o estágio que determina o fim do processo de acoplamento excitação-contração. O nível de Ca2+ liberado e a proporção reabsorvida pelo retículo sarcoplasmático, portanto, definem a conduta funcional do ciclo contrátil (Figura 1).
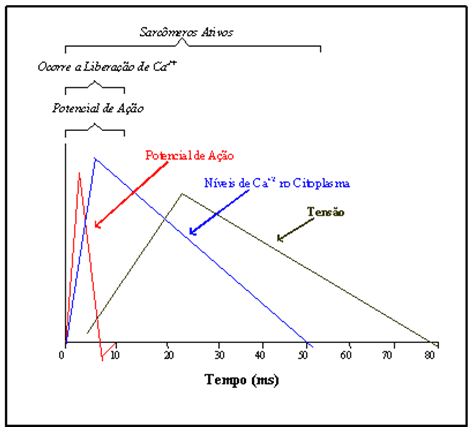
Figura 1. Relações estabelecidas entre potencial de ação muscular, nível citoplasmático de Ca2+ e
desenvolvimento de tensão pelos sarcômeros durante um abalo. Adaptado de Schauf et al. (1993)
Estudos também relatam que a impossibilidade de captação do Ca2+ do citoplasma para o interior do retículo sarcoplasmático, em condição após a contração muscular, pode desencadear seqüências de eventos lesivos em estruturas celulares. Isso indica que há uma concentração de Ca2+ favorável para a manutenção da homeostasia celular (Antunes Neto et al., 1998). O objetivo deste trabalho é apresentar a atuação do Ca2+ nas situações de equilíbrio do funcionamento contrátil e sua influência na ativação de mecanismos lesivos celulares.
Ação do cálcio nos eventos funcionais celulares
No músculo esquelético, a excitabilidade e contratilidade dependem do potencial de membrana e dos gradientes de concentração transmembrana para sódio (Na+) e potássio (K+). Estes gradientes são mantidos por transporte ativo eletrogênico através do sarcolema, sendo os potenciais de ação obtidos por influxo de Na+ e refluxo de K+. Por causa da ampla e rápida mudança de permeabilidade, a capacidade da bomba Na+-K+ para liberação de Na+ e acumulação de K+ pode, transitoriamente, exceder-se durante determinado esforço muscular. Dependendo da freqüência de excitação, a condição excedente leva a um aumento em Na+ intracelular e K+ extracelular, o que pode interferir na capacidade da bomba Na+-K+ em relação à performance contrátil (Nielsen, Clausen, 1996).
Em condições ideais, a despolarização propagada é conduzida para o interior da fibra muscular pelo sistema tubular transverso. O sistema tubular transverso invagina do sarcolema em direção ao interior da fibra muscular em intervalos regulares, tendo como função dispersar rapidamente o potencial de ação. A rede tubular transversa atua como uma barreira para Ca2+ extracelular milimolar, assegurando a permanência da condição basal do Ca2+ sarcoplasmático no nível nanomolar. Tal como na membrana plasmática de outros tipos celulares, tanto o sarcolema quanto as membranas do sistema tubular transverso contêm processos de transporte ATP-Ca2+ dependente que movem Ca2+ para fora da célula muscular. A atividade da bomba Na+/Ca2+ também atua neste sistema de superfície da membrana para transporte de Ca2+ (Mickelson, Louis, 1996).
O complexo excitação-contração envolve todos os estágios entre o potencial de ação e a ligação de Ca2+ à troponina, levando ao desenvolvimento de tensão:
Quadro 1. Seqüência dos eventos excitação-contração do músculo

O processo de contração muscular baseia-se na teoria do deslizamento dos filamentos do sarcômero. Cinco fases podem ser delineadas em relação aos eventos mecânicos e fisiológicos deste processo: repouso, excitação-junção, contração, restauração e relaxamento (Antunes Neto, 1998; Fox et al., 1991):
Neste momento, não há interação entre actina e miosina, pois o complexo ATP-ponte cruzada está desativado. O Ca2+, elemento fundamental para a mudança da configuração troponina/tropomiosina (em repouso, as duas estruturas “cobrem” os sítios de ligação entre actina e miosina), encontra-se armazenado nas vesículas do retículo sarcoplasmático. Quando a membrana está em repouso ou numa condição de equilíbrio (sem condução de sinal), o potencial elétrico através da membrana permanece relativamente constante. O potencial de repouso da membrana é da ordem de 60-90 mV, com o lado interior da membrana sendo negativo em relação ao exterior. A distribuição iônica pela membrana representa o equilíbrio das forças elétricas entre os íons positivos e negativos e suas forças associadas de concentração. A bomba sódio-potássio (bomba Na+-K+) é responsável pela manutenção deste balanço iônico: no estado de repouso, Na+ é impedido de entrar na célula por meio da atividade da bomba, sendo transportado do fluido intracelular para o fluido extracelular; a concentração de K+ é mantida internamente pela atividade da bomba Na+-K+ e pela atração elétrica a vários ânions orgânicos.1. Repouso.
2. Excitação-Junção. A ruptura da distribuição iônica através da membrana resulta em mudança do potencial de ação: por exemplo, o movimento de íons negativos para o exterior da membrana e positivos para o lado interno produzirá um decréscimo no potencial da membrana (despolarização), enquanto que o movimento de íons negativos internamente ou a deposição de íons positivos adicionais externamente causará uma hiperpolarização da membrana. Quando um impulso vindo de um nervo motor atinge a placa motora terminal ou junção neuromuscular (ponto onde a fibra nervosa motora se invagina para dentro da fibra muscular), há a liberação de acetilcolina, tornando possível a transmissão do impulso neuronal através da fenda sináptica e também criando um potencial pós-sináptico excitatório na fibra muscular. O potencial pós -sináptico excitatório se dá em decorrência do aumento no potencial elétrico no neurônio pós-sináptico. A geração de potenciais de ação sofre propagação pelo sarcolema e túbulos transversos, tendo como evento final a estimulação das vesículas do retículo sarcoplasmático e a liberação de Ca2+ no meio intracelular. O aumento na concentração interna celular de Ca2+ propiciará a este ligar-se às moléculas de troponina, que cobrem os sítios de ligação da actina junto à miosina. A ligação do Ca2+ com a troponina desencadeará uma alteração na conformação do complexo troponina/tropomiosina, levando à ativação do ATP- ponte cruzada e a um acoplamento físico-química entre actina e miosina.
3. Contração. Com o acoplamento entre actina e miosina, tem-se a ativação da enzima ATPase dependente de Mg2+ e a subseqüente hidrólise do ATP, permitindo a desintegração de ATP em ADP e Pi. A hidrólise permite a liberação de energia e a mudança de angulação das pontes cruzadas, acarretando na sobreposição dos filamentos de actina aos de miosina e gerando a contração muscular.
4. Restauração. A formação de uma nova ligação entre actina e miosina se dá através da ressíntese do ATP. A energia para a ocorrência da ressíntese deriva da decomposição de glicose, glicogênio, ácidos graxos livres ou da combinação de ADP (adenosina difosfato) com grupos fosfato da fosfocreatina. A restauração de alguns poucos moles de ATP pode ser obtida ainda pela via da glicólise anaeróbia, resultando na produção de ácido lático.
5. Relaxamento. Quando há o cessamento dos impulsos nervosos e a diminuição de estímulo sobre o nervo motor, os íons de Ca2+ ligados aos sítios da troponina são “seqüestrados” de volta às cisternas do retículo sarcoplasmático. Com a diminuição da concentração intracelular de Ca2+, o complexo ATP-ponte cruzada é desativado e os miofilamentos de actina retornam à posição inicial para propiciarem a ocorrência de um novo ciclo contrátil.
A Figura 2 representa esquematicamente os principais eventos envolvidos no processo de contração muscular:
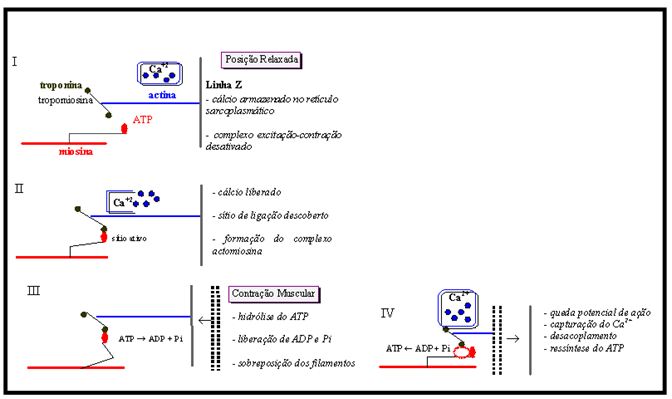
Figura 2. O processo de contração-relaxamento muscular (Antunes Neto, 1998)
Bombas de cálcio, retículo sarcoplasmático e desempenho contrátil
Martonosi (1984) descreve os dois tipos de bomba de Ca2+ presentes na superfície das membranas celulares:
-
uma enzima ATPase ativada por íons magnésio e cálcio ([Mg2+ + Ca2+] - ATPase) está presente na membrana plasmática da maioria das células eucarióticas; esta ATPase é modulada pela calmodulina e requer fosfolipídios da membrana para a atividade. A clivagem Ca2+-dependente de ATP ocorre com formação transitória de uma enzima acilfosfato intermediária, que é mecanicamente ligada à translocação de Ca2+.
-
o sistema de permutação Na+-Ca2+ catalisa a troca eletrogênica de sódio e cálcio através da superfície da membrana. A bomba Na+-Ca2+ está presente em alta concentração nas superfícies de membranas de células excitáveis (por exemplo, células do coração e axônios). A bomba Na+-Ca2+ não está ligada à hidrólise do ATP, mas o ATP pode servir como um ativador fisiológico. Nas superfícies de membranas de micro-organismos, anti-carregadores H+:Ca2+ podem desempenhar uma função regulatória similar.
Ainda em relação às bombas de Ca2+, o retículo endoplasmático da maioria das células eucarióticas contém uma bomba ATP-Ca2+ dependente, que é distinta da [Mg2+ + Ca2+] - ATPase da superfície de membrana. A bomba de Ca2+ é um componente intrínseco da membrana do retículo endoplasmático e em certas células (por exemplo, nas células musculares) ela pode representar 50-80% do conteúdo total de proteína do retículo endoplasmático. A bomba ATP-Ca2+ dependente cataliza o transporte eletrogênico de 2 Ca2+ ligados à hidrólise de 1 mol de ATP, contra um largo gradiente eletroquímico de Ca2+. A atividade do transporte ATPase depende absolutamente dos fosfolipídios da membrana, sendo a fosforilação transitória da enzima pelo ATP um essencial passo na translocação do cálcio. Diferente da superfície da membrana Ca2+-ATPase, a enzima do retículo endoplasmático é relativamente insensível à calmodulina. Um exemplo bem caracterizado deste sistema de transporte de cálcio é a ATPase transportadora de cálcio do retículo sarcoplasmático (Martonosi, 1984).
O retículo sarcoplasmático é, primariamente, responsável pela regulação da concentração de Ca2+ sarcoplasmático. Uma rede de retículos sarcoplasmáticos envolve as miofibrilas no nível da junção Banda A e Banda I e forma cisternas terminais das quais estruturas são projetadas para os túbulos transversos. A ramificação de cisternas terminais forma um alongado sistema tubular longitudinal, que origina a porção leve do retículo sarcoplasmático, esta que é altamente enriquecida na atividade da bomba ATP-Ca2+ dependente, enquanto a liberação de Ca2+ e as atividades de ligação de Ca2+ são enriquecidas na porção pesada do retículo sarcoplasmático (derivada das cisternas terminais). A bomba ATP-Ca2+ dependente é responsável pela reacumulação muito rápida de Ca2+ no interior do retículo sarcoplasmático seguindo a sua liberação. O canal de liberação de Ca2+ ou receptor rianodina é o principal mecanismo pelo qual o cálcio estocado nas cisternas do retículo sarcoplasmático é liberado no sarcoplasma para iniciar a contração muscular, sendo ativado por Ca2+ micromolar e adenina nucleotídeo milimolar (também é sensível à mudança de pH, calmodulina, cafeína, entre outros); em contrapartida, o canal de liberação de Ca2+ é inibido por Ca2+ milimolar e Mg2+ milimolar. Em conjunto com o receptor rianodina, tem-se a atuação de receptores dihidropiridina, que, com a sua alteração estrutural detectada através de movimentos intramembrana, estimulam a mudança no potencial da membrana e parecem essenciais para a liberação de Ca2+ do retículo sarcoplasmático (Martonosi, 1984; Pozzan et al., 1994; Mickelson, Louis, 1996).
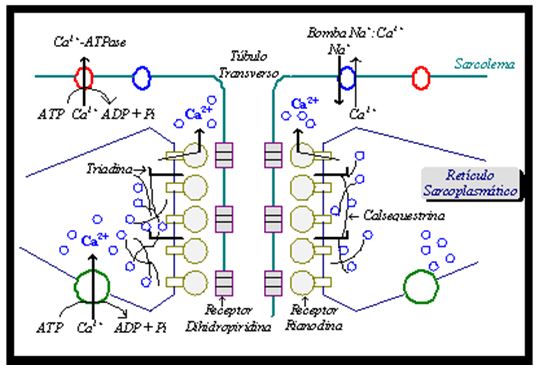
Figura 3. Membranas e proteínas responsáveis pela regulação do cálcio no sistema músculo-esquelético. Adaptado de Mickelson e Louis (1996)
O aumento na concentração de Ca2+ citoplasmático dos níveis de repouso de < 10-7 M para @ 10-6 M induz a uma alteração na configuração estrutural dos filamentos finos do sarcômero, facilitando a interação entre as pontes cruzadas e a actina, com a subseqüente ativação da clivagem cíclica de ATP e o desenvolvimento de tensão contrátil. Em termos gerais, a calsequestrina e a calreticulina, localizadas no espaço luminal das cisternas terminais do retículo sarcoplasmático, serão as proteínas que realizarão o tamponamento luminal das mudanças de concentração de Ca2+ livre ([Ca2+]i). Propõe-se que a proteína triadina desempenhe um papel de “ancorar” a calsequestrina na membrana juncional e medie interação entre calsequestrina e o receptor rianodina (Martonosi, 1984; Pozzan et al., 1994; Mickelson, Louis, 1996).
As evidências experimentais sugerem que a estrutura do retículo sarcoplasmático e sua função são prontamente alteradas quando o tecido muscular é submetido a uma prática exaustiva de exercícios excêntricos, de modo que possa haver um eventual distúrbio nas proporções dos canais regulatórios de liberação e recapturação de Ca2+ pelo retículo sarcoplasmático (Warren et al., 1993a).
O que se pode pressupor é que a instabilidade mecânica produzida durante o exercício excêntrico afeta as ultraestruturas da célula muscular, induzindo ruptura dos sarcômeros e sarcolema (Figura 4) (Clarkson, 1992 a,b). Porém, não se sabe ao certo precisar a participação de demais eventos que surgem em paralelo ao estresse mecânico, pois muitas mudanças homeostáticas podem ocorrer durante a realização de um exercício intenso, tais como alterações em substratos, elevação da temperatura local, produção de radicais superóxido, depressão em pH e elevação em concentração de Ca2+ citoplasmático (Byrd et al., 1989a).

Figura 4. Processos de lesão induzidos pelo exercício excêntrico. Adaptado de Byrd (1992)
Os mecanismos pelos quais tornam elevados o nível de Ca2+ no interior das células musculares, sejam eles de causa intracelular ou extracelular, também não estão completamente evidenciados. Duan e colaboradores (1990), utilizando-se de modelo animal que foi submetido a um prolongado exercício de caminhada em esteira em plano de descida, o que eles denominaram de exercício excêntrico, procuraram compreender a origem do Ca2+ acumulado na célula. Concluíram que o Ca2+ pode entrar na célula ou através dos canais de Ca2+ do sarcolema, haja visto que a tensão ocasionada pelo exercício excêntrico favorece uma movimentação dos íons pela membrana, ou então que a causa seja a própria ruptura de alguma estrutura sarcolemal, resultada de um fator ou combinação de fatores: tensão mecânica, ativação de Fosfolipase A2, peroxidação lipídica por radicais livres de oxigênio e aumento de temperatura local produzida durante o exercício. O Ca2+ acumulado poderá, desta forma, alterar relações de síntese e degradação protéica no músculo por intermédio de estimulação de processos sensíveis à sua concentração elevada (Baggiolini et al., 1988; Byrd et al., 1989b). Porém, os experimentos de Lowe e equipe (1994) demonstraram que animais que executaram uma sessão de exercícios excêntricos do músculo sóleo foram capazes de tamponar o aumentado influxo de Ca2+ extracelular, mantendo a [Ca2+] sistólica normal e evitando a ativação de vias degradativas sensíveis ao Ca2+. Desta forma, mais investigações são necessárias para o entendimento de lesões induzidas pelo exercício excêntrico. Armstrong (1990) apresenta o pressuposto potencial de alcance do Ca2+ nos processos relativos aos mecanismos de lesão no meio celular (Figura 5):
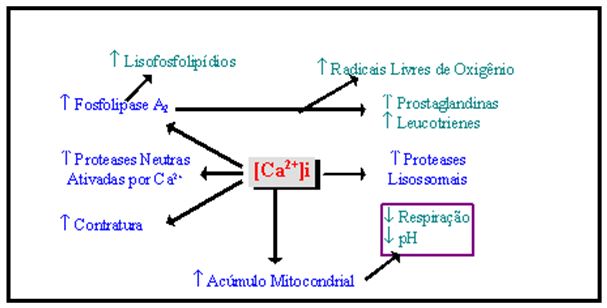
Figura 5. Mecanismos potenciais envolvidos nos estágios iniciais de microlesão celular
que ocorrem por aumento intracelular de cálcio. Adaptado de Armstrong (1990)
Concluindo, o distúrbio homeostático do Ca2+ na célula pode conduzir alguns processos auto-catalíticos. Analisando o esquema, percebe-se que a concentração elevada de Ca2+ favorece a ativação da Fosfolipase A2, que possui um sítio de ligação de Ca2+. A ação da Fosfolipase A2 pode ter vários efeitos degenerativos para as estruturas de membrana, incluindo a produção de detergentes de ácidos graxos e lisofosfolipídios. O Ca2+ pode, também, ativar outras proteases sensíveis, estimulando a degradação de estruturas protéicas, bem como afetando o processo de respiração mitocondrial.
Referências bibliográfica
-
ANTUNES NETO, J. M. F. Modificações morfo-funcionais do tecido muscular induzidas pela atividade excêntrica: um estudo global dos processos adaptativos. Dissertação de Mestrado. Universidade Estadual de Campinas: Faculdade de Educação Física, 1998.
-
ARMSTRONG, R. B. Initial events in exercise-induced muscular injury. Medicine and Science in Sports and Exercise, v. 22, n. 04, p. 429-435, 1990.
-
BAGGIOLINI, M., TSCHARNER, V. V., WYMANN, M. P. et al. Activation of human neutrophils: intracellular calcium changes and the onset of the respiratory burst. In: GLAUERT, A. M. (org.). The control of tissue damage: research monographs in cell and tissue physiology. Amsterdam: Elsevier, v. 15, 1988.
-
BYRD, S. K. Alterations in the sarcoplasmatic reticulum: a possible link to exercise-induced muscle damage. Medicine and Science in Sports and Exercise, v. 24, n. 05, p. 531-536, 1992.
-
BYRD, S. K., BODE, A. K., KLUG, G. A. Effects of exercise of varying duration on sarcoplasmatic reticulum function. Journal of Applied Physiology, v. 66, n. 03, p. 1383-1389, 1989a.
-
BYRD, S. K., MCCUTCHEON, L. J., HODGSON, D. R. et al. Altered sarcoplasmatic reticulum function after high-intensity exercise. Journal of Applied Physiology, v. 67, n. 05, p. 2072-2077, 1989b.
-
CLARKSON, P. M. Exercise-induced muscle damage - animal and human models. Medicine and Science in Sports and Exercise, v. 24, n. 05, p. 510-511, 1992.
-
CLARKSON, P. M., NOSAKA, K., BRAUM, B. Muscle function after exercise-induced muscle damage and rapid adaptation. Medicine and Science in Sports and Exercise, v. 24, n. 05, p. 512-520, 1992.
-
DUAN, C., DELP, M. D., HAYES, D. A., et al. Rat skeletal muscle mitochondrial [Ca+2] and injury from dowhill walking. Journal of Applied Physiology, v. 68, n. 03, p. 1241-1251, 1990.
-
FOX, E. L., BOWERS, R. W., FOSS, M, L. Bases fisiológicas da educação física e dos desportos. Rio de Janeiro: Guanabara, 4a. edição, 1991.
-
HANSFORD, R. G. Role of calcium in respiratory control. Medicine and Science in Sports and Exercise, v. 26, n. 01, p. 44-51, 1994.
-
LOWE, D. A., WARREN, G. L., HAYES, D. A. et al. Eccentric contraction-induced injury of mouse soleus muscle: effect of varying [Ca2+]. Journal of Applied Physiology, v. 76, n. 04, p. 1445-1453, 1994.
-
MARTONOSI, A. N. Mechanisms of Ca2+ release from sarcoplasmatic reticulum of skeletal muscle. Physiological Reviews, v. 64, n. 04, p. 1240-1320, 1984.
-
MICHELSON, J. R., LOUIS, C. F. Malignant hyperthermia: excitation-contraction coupling, Ca2+ release channel, and cell Ca2+ regulation defects. Physiological Reviews, v. 76, n. 02, p. 537-592, 1996.
-
NIELSEN, O. B., CLAUSEN, T. The significance of active Na+, K+ transport in the maintenance of contractility in rat skeletal muscle. Acta Physiologica Scandinavica, v. 157, n. 02, p. 199-209, 1996.
-
POZZAN, T., RIZZUTO, R., VOLPE, P. et al. Molecular and cellular physiology of intracelular calcium stores. Physiological Reviews, v. 74, n. 03, p. 595-636, 1994.
-
SCHAUF, C., MOFFETT, D., MOFFETT, S. Fisiologia humana. Rio de Janeiro: Guanabara, 1993.
-
WARREN, G. L., HAYES, D. A., LOWE, D. A. et al. Mechanical factors in the initiation of eccentric contraction-induced injury in rat soleus muscle. Journal of Physiology, v. 464, p. 457-475, 1993a.
-
WARREN, G. L., HAYES, D. A., LOWE, D. A. et al. Materials fatigue initiates eccentric contraction-induced injury in rat soleus muscle. Journal of Physiology, v. 464, p. 477-489, 1993b.
Outros artigos em Portugués
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista Digital · Año 17 · N° 169 | Buenos Aires,
Junio de 2012 |
|