
|
|||
|---|---|---|---|
|
|
Formação de espécies reativas de oxigênio e exercício físico La formación de especies reactivas de oxigeno y el ejercicio físicoReactive oxygen species generation and physical exercise |
|
|
|
Doutor em Biologia Funcional e Molecular, Departamento de Bioquímica Instituto de Biologia, Universidade Estadual de Campinas/UNICAMP (Brasil) |
Joaquim Maria Ferreira Antunes Neto |
|
|
|
Resumo As espécies reativas de oxigênio (EROs) surgem da instabilidade de seus elétrons desemparelhados, o que gera alto potencial de reatividade com moléculas biológicas. O ataque que é proporcionado possibilita oxidação de estruturas de membranas celulares e até mesmo do ácido desoxirribonucléico (DNA). Em situação extrema, observa-se a instalação do quadro de estresse oxidativo, caracterizado, sobretudo, pela diminuição da atividade do sistema antioxidante. O exercício físico pode ser uma estratégia para elevar os níveis antioxidantes e contribuir com a melhoria de rendimento físico. Unitermos: Radicais livres. Atividade antioxidante. Exercício físico.
Abstract The reactive oxygen species (ROS) arise from the instability of their unpaired electrons, which generates high potential reactivity with biological molecules. The attack is provided which enables oxidation of cell membranes and structures even deoxyribonucleic acid (DNA). In an extreme situation, we observe the onset of the oxidative stress, mainly characterized by the reduced activity of the antioxidant system. Exercise can be a strategy to increase antioxidant levels and contribute to the improvement of physical performance. Keywords: Free radicals. Antioxidant activity. Physical exercise.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires - Año 17 - Nº 168 - Mayo de 2012. http://www.efdeportes.com/ |
|
|
1 / 1
Introdução
Radicais livres são espécies químicas independentes, que possuem um ou mais elétrons desemparelhados. Isto implica em uma grande instabilidade e, freqüentemente, elevada reatividade. Como necessitam completar seus pares de elétrons para se estabilizarem, comportam-se ou como receptores (oxidantes) ou como doadores (redutores) de elétrons. Nesta definição incluem-se os átomos de hidrogênio, vários íons metálicos de transição (ferro e cobre) e o oxigênio molecular (Halliwell, Gutteridge, 1989). O objetivo desta revisão é mostrar como as espécies reativas originadas do oxigênio – espécies reativas de oxigênio (EROs) – podem causar alterações em propriedades celulares, induzindo um evento classificado como estresse oxidativo. Também, ilustraremos como o organismo consegue, através do exercício físico, elevar a capacidade de seu sistema de defesa antioxidante.
Formação das EROs
O oxigênio molecular (O2) possui dois elétrons desemparelhados, localizados em dois orbitais p*2p. Esses elétrons têm spins iguais, tornando o O2 bastante estável, pois restringe sua redução ou a moléculas que possuam dois elétrons de spins antiparalelos ou a uma redução univalente, com um elétron de cada vez. A este fenômeno chamamos restrição de spin. Esta restrição limita a reatividade do oxigênio, permitindo que em uma atmosfera de 21% de O2, como a da Terra, ocorram moléculas constituídas de cadeias carbônicas altamente reduzidas (Halliwell, Gutteridge, 1989). Nos organismos aeróbios, o O2 é utilizado nas mitocôndrias como aceptor final de elétrons na cadeia respiratória, sendo reduzido a H2O no complexo IV ou citocromo a3. Por força da restrição de spin, o O2 só pode ser reduzido unieletronicamente (ver Figura 1).
As quatro etapas de redução ocorrem no interior do complexo IV mitocondrial, liberando H2O como único produto final da reação. No entanto, está bem documentado na literatura que cerca de 5% do oxigênio consumido é reduzido ao radical ânion superóxido (O2-.), uma forma muito comum de formação de radicais livres nos meios biológicos. O exercício físico aumenta em torno de 25 vezes o volume de oxigênio total consumido (VO2) e 100 vezes nas fibras musculares ativas (Astränd, Rodahl, 1986; Sjödin et al., 1990), permitindo que o O2- possa ser formado de várias maneiras (Beckman et al., 1990; Sjödin et al., 1990; Jenkins, Goldfarb, 1993; Reid, 1996; Tiidus, 1998):
-
Cadeia de Transporte de Elétrons – Uma das principais fontes de O2-. é o vazamento de elétrons que ocorre na cadeia respiratória mitocondrial. Sabe-se que cerca de 5% do oxigênio consumido pelas mitocôndras geram O2-., principalmente nos complexos I (NADPH-ubiquinona oxidoredutase) e complexo III (citocromo c redutase).
-
Enzima Xantina Oxidase – As reações catalisadas pela xantina oxidase mostram-se uma fonte importante de O2-., principalmente durante situações de isquemia/reperfusão, quando ocorre grande produção de hipoxantina. Durante exercícios intermitentes de alta intensidade, quando a velocidade de quebra do ATP excede a da fosforilação do ADP, pode ocorrer acúmulo de ADP na musculatura. A fim de manter uma razão ATP/ADP alta, a enzima adenilato quinase catalisa a seguinte reação: ADP + ADP ® ATP + AMP. A desaminação subseqüente do AMP a IMP é importante para permitir a ressíntese de ATP por essa via. O IMP é transformado em hipoxantina. Em situações normais a hipoxantina é degradada a ácido úrico pela ação da forma desidrogenase da enzima, que utiliza NADP+ como aceptor de elétrons. Porém, em baixas concentrações de O2 e altas concentrações intracelulares de Ca2+, a enzima é transformada na sua forma oxidase, que utiliza O2 como aceptor de elétrons, produzindo também O2-. no final do processo (Sjödin et al., 1990).
-
Neutrófilos e Resposta Inflamatória (NADPH oxidase) – Neutrófilos polimorfonucleares são células sangüíneas que possuem a função de promover a inflamação pós-exercício, importante para a remoção de proteínas danificadas e restos celulares e reparo do tecido danificado. Dessa forma, quando recrutados para o foco da infecção, liberam primordialmente dois fatores, lisoenzimas e O2-.. A produção de O2-. pelos neutrófilos ocorre através da redução univalente do O2 na presença de NADPH, numa reação catalisada pela enzima NADPH oxidase, num processo conhecido como burst respiratório.
-
Músculo Esquelético - O músculo esquelético produz óxido nítrico (NO) a partir do aminoácido arginina, pela reação da enzima óxido nítrico sintase. O óxido nítrico pode reagir com O2-., formando peroxinitrito, um intermediário instável, de alta reatividade (Reid, 1998). Evidências experimentais mostram que o NO pode influenciar no balanço oxidante/antioxidante intramuscular (Reid, 1998; Reid, 2002).
A superóxido dismutase (SOD), uma enzima do sistema de defesa antioxidante catalisa a dismutação de duas moléculas de O2·-, formando H2O2, uma espécie não radicalar, considerada como um agente oxidante fraco (reação 1). Contudo, H2O2 tem a propriedade de atravessar facilmente membranas celulares e a união com um elétron proveniente de metais de transição, Fe2+ ou Cu+ dá origem ao radical hidroxila (·OH), uma das espécies radicalares existentes mais reativas (reação 2) (Ryan, Aust, 1992; Jenkins, Goldfarb, 1993).
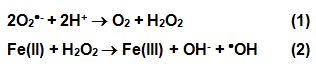
A mitocôndria é o sítio subcelular para os estágios finais da maioria dos eventos oxidativos biológicos. Relembrando que a oxidação ocorre por adição de oxigênio, remoção de hidrogênio ou transferência de elétrons, a origem primária da produção metabólica de radicais relaciona-se juntamente com a fase de transferência de elétrons. A oxidação mitocondrial normalmente se dá por quatro reações de transferência de elétrons, conforme ilustra a Figura 1. O substrato doador de elétrons é sempre uma coenzima reduzida, tendo-se como aceptor final de elétrons o oxigênio. Os transportadores de elétrons, na sua maioria, possuem natureza protéica e grupos prostéticos associados à cadeia polipeptídica. A NADH desidrogenase, que oxida NADH, tem como grupo prostético a flavina mononucleotídio (FMN), derivada da riboflavina. As proteínas ferro-enxofre dos complexos I, II e III são apenas transportadoras de elétrons, não recebendo prótons. Os elétrons são recebidos pelos átomos de ferro, que oscilam entre as formas Fe2+ e Fe3+ de acordo com os estados de redução ou oxidação. A coenzima Q tem função imprescindível no transporte de elétrons, pois as suas características hidrofóbicas permitem mobilidade em membranas lipídicas, diferentemente dos outros componentes da cadeia, que têm posições fixas. Os citocromos diferem-se quanto ao grupo prostético e à sua forma de ligação na cadeia protéica. A organização dos citocromos na cadeia de transporte de elétrons está intimamente relacionada com a possibilidade de realização da reação final - o recebimento dos elétrons pelo oxigênio e a ligação com prótons do meio, formando água -, pelo fato do citocromo a3 ser o único capaz de reagir diretamente com o oxigênio (Antunes Neto, 1998).

Figura 1. Complexos componentes da cadeia transportadora de elétrons
Complementando, a formação de radicais livres pode resultar em falha do transporte de elétrons realizado pela coenzima Q, a qual reduz oxigênio molecular univalentemente, formando radicais O2-. (Lawler et al., 1997). O radical O2-. é rapidamente convertido a O2 e H2O pela enzima superóxido dismutase, localizada no espaço da matriz mitocondrial. O H2O2 é removido pela ação das duas outras enzimas antioxidantes: a glutationa peroxidase (GPX), encontrada principalmente na mitocôndria e citosol, e a catalase (CAT), presente nos peroxissomas. A função das enzimas GPX e GR (glutationa redutase) é induzir a remoção de H2O2. GSH (glutationa reduzida) é reduzida a glutationa dissulfeto (GSSG) através da GPX e, durante o processo de redução de H2O2 a H2O e O2, a GSH é restabelecida pela GR. A CAT também atua nas reações de redução, só que em sítios externos ao meio mitocondrial (Figura 2). A formação das espécies reativas de oxigênio e a possível ação destrutiva oxidativa podem se dar quando há a inibição do sistema enzimático antioxidante, uma vez que SOD é inibida por H2O2 e por certos metais transitórios, o que propicia a formação de radicais hidroxila (OH·), para os quais o organismo não possui um sistema defensivo disponível (Antunes Neto, 1998).
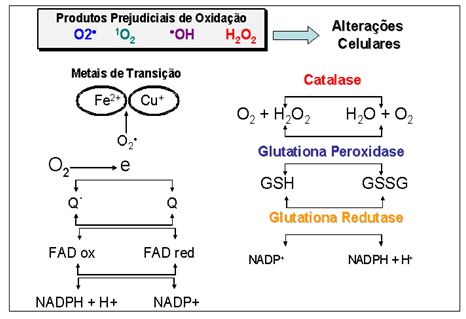
Figura 2. A relação do metabolismo intermediário com o potencial de estresse oxidativo
Como os radicais livres são espécies de alta instabilidade, atacam regiões celulares específicas, principalmente fosfolipídios de membranas celulares e subcelulares, proteínas e DNA nuclear e mitocondrial, com o objetivo de se estabilizar (Halliwell, Guteridge, 1989). A oxidação de lipídeos, processo conhecido como peroxidação lipídica, pode iniciar-se em membranas celulares e sub-celulares, especialmente na membrana interna das mitocôndrias, quando o .OH abstrair o hidrogênio das ligações C¾H da cadeia dos ácidos graxos poliinsaturados. Os carbonos dos fosfolipídios, uma vez oxidados, passam a possuir elétrons desemparelhados, desencadeando as seguintes reações em cascata mostradas na Figura 3.
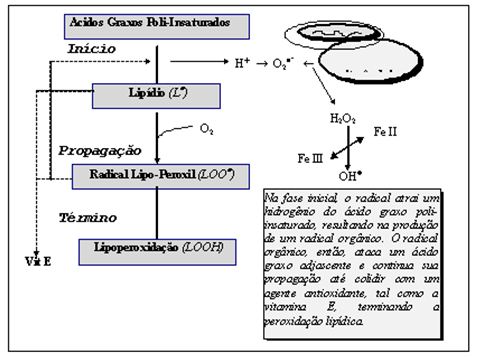
Figura 3. O processo de propagação da atividade do ânion superóxido. Adaptado de Jenkins e Goldfarb (1993)
Os radicais lipídicos desemparelhados (L-) rearranjam-se molecularmente em dienos conjugados, que ao reagir com O2 formam radicais peróxi (LOO-); radicais peróxi, pelo fato de serem oxidantes potentes, abstraem um segundo átomo de hidrogênio de um ácido graxo adjacente, dando continuidade aos processos degenerativos na membrana. Assim, o radical iniciador começa um processo autocatalítico, que converte a maioria dos ácidos graxos dos fosfolipídios das membranas em hidroperóxidos. Os hidroperóxidos lipídicos formados, na presença de Fe2+, podem ainda ser oxidados a radicais alcoxi (LO-), vindo a sofrer quebra na ligação C ¾ C seguinte e originar aldeídos de baixo peso molecular (malonaldeído, b-hidroxinonenal e hidrocarbonetos, como etano e n-pentano). Esses aldeídos de baixo peso molecular reagem com ácido tiobarbitúrico (TBA), formando complexos que podem ser quantificados em virtude da coloração obtida. Tais complexos, utilizados como biomarcadores de peroxidação lipídica em sistemas biológicos (tecidos e plasma) são medidos por espectrofotometria ou por fluorescência (Yagi, 1976; Ohkawa et al., 1979). A peroxidação lipídica traz conseqüências homeostáticas severas para as membranas atacadas, refletidas, principalmente, na perda de sua integridade, devido à alteração na sua permeabilidade a íons e pequenas moléculas e perda nas suas características de fluidez (Halliwell, Guteridge, 1989).
No caso das proteínas, os aminoácidos também constituem-se num alvo importante da ação das EROs, tendo suas estruturas secundárias e terciárias rompidas, com subseqüente aumento de hidrofobicidade e perda de função. O .OH é particularmente proteotóxico, pois pode reagir com o carbono a de qualquer aminoácido (Halliwell, Guteridge, 1989). Além de modificar a função protéica, sua oxidação também pode marcá-las para serem degradadas em peptídeos e, eventualmente, em aminoácidos. Muitos produtos associados com perda ou alteração morfofuncional protéica podem ser obtidos após ataque oxidativo de EROs, entre eles hidroxilação de aminoácidos aromáticos, oxidação de aminoácidos que possuem enxofre (cisteína), peroxidação de aminoácidos alifáticos e formação de grupos carbonila (Dean et al., 1987).
Detalhes funcionais do sistema de defesa antioxidante
A atividade biológica das EROs é limitada por uma série de antioxidantes endógenos e proteínas relacionadas ao estresse (Buczýnski et al., 1990; Goldfarb, 1993; Smolka et al., 2000; Reid, Durham, 2002). Os principais sistemas de defesa endógenos compreendem as vitaminas antioxidantes (vitaminas A, C e E), ácido úrico, glutationa reduzida (GSH), grupamentos sulfidrila livres e enzimas antioxidantes (superoxido dismutase, catalase e sistema glutationa peroxidase/glutationa redutase). As enzimas antioxidantes constituem o principal mecanismo de defesa antioxidante intracelular, pois eliminam O2·-, H2O2 e hidroperóxidos que poderiam oxidar os substratos celulares, prevenindo as reações em cadeia dos radicais livres, através da diminuição na concentração disponível destes para iniciar o processo (Yu, 1994).
A primeira defesa contra o radical O2·- é a enzima superóxido dismutase (SOD). A SOD, como já apresentando, dismuta o radical O2·-, formando H2O2 e O2. Nos mamíferos, existem duas isoenzimas de SOD; a Cu-Zn-SOD, que localiza-se primariamente no citosol e a Mn-SOD encontrada de forma mais pronunciada na matriz mitocondrial (Halliwell, Gutteridge, 1989). Ambas enzimas catalisam a dismutação do radical O2·- com eficiência similar (Powers et al., 1999). A literatura indica que a atividade da SOD é mais pronunciada nos músculos com capacidade oxidativa elevada (maior porcentagem de fibras do tipo I e IIa), em comparação com músculos com baixa capacidade oxidativa (com grande percentual em fibras do tipo IIb) (Criswell et al., 1993; Powers et al., 1994). O H2O2 é desidratado enzimaticamente a H2O e O2 molecular pela enzima catalase (CAT), conforme mostrado abaixo:
![]()
A CAT é encontrada, sobretudo, nos hepatócitos e eritrócitos, estando presente em grandes concentrações nos peroxissomas e em baixas concentrações nas mitocôndrias (Halliwell, Gutteridge, 1989). Sua atividade também é maior nos músculos com capacidade oxidativa mais elevada (Powers et al., 1994). A outra enzima responsável pela detoxificação do H2O2, glutationa peroxidase (GPX), tem menos especificidade para o substrato, reduzindo também hidroperóxidos a álcool. O km para H2O2 da CAT e GPX também são diferentes. Enquanto a GPX atinge sua Vmax em baixas concentrações, a CAT só atinge sua velocidade máxima de catálise em altas concentrações de H2O2 (Powers et al., 1999). Nas duas reações catalisadas pela GPX, a glutationa reduzida (GSH) funciona como doador de elétrons:
![]()
A glutationa (GSH) é um tripeptídeo formado pelos aminoácidos glicina, cisteína e ácido glutâmico. Quando GSH é oxidada pela reação da GPX, há a interligação de duas moléculas do tripeptídeo por uma ponte dissulfeto, com formação de glutationa oxidada (GSSG). Queda nos níveis de GSH pode prejudicar as defesas celulares contra a ação tóxica dos radicais livres. As células íntegras mantêm uma razão GSH/GSSG alta. Para isso, a GSSG formada é reduzida novamente a GSH, às custas de NADPH, pela ação da enzima glutationa redutase (GR):
![]()
Em muitos tecidos, o NADPH é produzido pela enzima glicose-6 fosfato desidrogenase. Contudo, na musculatura esquelética a via principal advém da ação da enzima isocitrato desidrogenase (Powers et al., 1999). A atividade da GPX é variada, estando presente tanto nas fibras musculares mais oxidativas (tipo I) quanto nas mais glicolíticas (tipo IIb) (Ji et al., 1988). Similarmente a SOD, GPX está localizada no citosol e na mitocôndria. No músculo esquelético, aproximadamente 45% da atividade da GPX é encontrada no citosol, sendo que os demais 55% de atividade ocorrem na mitocôndria (Ji et al., 1988). A GR possui uma distribuição similar a GPX. Embora não seja considerada uma das enzimas principais do sistema enzimático antioxidante, ela é fundamental para a atuação normalizada da GPX.
Estresse oxidativo, sistema enzimático antioxidante e exercício físico
Embora a maior parte do oxigênio combine-se com hidrogênio formando água, cerca de 4% a 5% de oxigênio formarão radicais O2·- com os elétrons que escapam da cadeia respiratória (Jenkins, Goldfarb, 1993). Esta situação de vazamento de elétrons tem maior ocorrência quando há um aumento desproporcional no consumo mitocondrial de oxigênio, circunstância que também confere uma elevação na produção de radicais livres. Portanto, existe uma relação diretamente proporcional entre aumento na taxa respiratória mitocondrial e indução na produção de espécies reativas de oxigênio, principalmente em casos que envolvem treinamento de resistência aeróbia utilizando-se métodos intervalados intensivos (Criswell et al., 1993). A explicação para tal fato parece relacionar-se com o elevado consumo total de oxigênio durante o intervalo da atividade, o que favorece a ocorrência de um processo conhecido por isquemia-reperfusão (Alessio, 1993). Fica evidente que a sobrevivência celular frente ao ataque dos radicais livres dependerá de um equilíbrio entre os processos de produção e de eliminação das espécies reativas. Qualquer circunstância que desequilibre estes dois processos induzirá a instalação de estresse oxidativo, quando prevalecerá a formação de oxidantes aos antioxidantes (Alessio, 1993). Neste caso, o acúmulo de reações de oxidação pode induzir alterações severas em várias estruturas celulares.
A ação das EROs sobre o sistema enzimático antioxidante parece ter relação direta com seu nível de produção (Alessio, 1993; Smolka et al., 2000). Vários trabalhos da literatura mostraram que indivíduos ou animais adaptados a um protocolo de treinamento possuíam níveis mais elevados de enzimas antioxidantes e certos oxidantes não enzimáticos no músculo, demonstrando uma resistência maior ao estresse oxidativo induzido pelo exercício físico (Sen, 1995; Radák et al., 1999; Smolka et al., 2000). Por outro lado, vários autores também mostraram um efeito inibitório na atividade dessas enzimas numa situação de exercício exaustivo, com aumento na concentração de produtos de ataque oxidativo (Davies et al., 1982; Sjödin et al., 1990; Ji et al., 1992; Smolka et al., 2000). A modulação dos antioxidantes enzimáticos e não enzimáticos em resposta ao treinamento físico tem sido descrita principalmente para o treinamento de endurance, caracterizado por volumes maiores e intensidades moderadas (Alessio, Goldfarb, 1988; Ji et al., 1988; Laughlin et al., 1990; Criswell et al., 1993; Sen et al., 1994; Powers et al., 1994; Tiidus, 1998). Já o treinamento de alta intensidade raramente é abordado quanto a sua influência sobre a modulação da defesa antioxidante, sendo pobremente descrito, com resultados ainda discrepantes.
Powers e colaboradores (1994) mostraram que ratos treinados exibiam alterações na atividade de enzimas antioxidantes específicas para cada músculo, encontrando também relação entre duração das sessões de treinamento maiores do que 60 min com o aumento da atividade da SOD no músculo sóleo e da GPX no músculo gastrocnêmio vermelho. Criswell e colaboradores (1993) compararam um treinamento intervalado (a aproximadamente 80-95% do VO2max) com um treinamento contínuo de menor intensidade (70% do VO2máx), identificando aumentos na atividade da GPX no músculo sóleo apenas para o grupo intervalado, enquanto a SOD teve sua atividade no músculo sóleo aumentada para os dois tipos de treinamentos. Atalay e colaboradores (1996) observaram aumentos nos níveis de glutationa total e nas atividades das enzimas GPX e GR em músculos de fibras rápidas e mistas de ratos submetidos a um treinamento de alta intensidade. Hellsten e colaboradores (1996) observaram em humanos aumentos nas atividades das enzimas GPX e GR no músculo após 7 semanas de treinamento intermitente de alta intensidade em bicicleta. Resultados prévios de nosso laboratório mostraram que após 8 semanas, o treinamento de endurance foi mais eficiente que o treinamento intermitente em aumentar a atividade das enzimas CAT e GR no músculo sóleo de ratos, com um efeito inverso sobre a atividade da enzima citrato sintase como marcador de capacidade oxidativa. Ou seja, o treinamento de endurance induziu um aumento menor na capacidade oxidativa que o treinamento intermitente, sugerindo que durante esse tipo de treinamento as próprias enzimas pudessem estar sendo atacadas pela maior quantidade de EROS formada (Smolka et al., 2000).
Considerações finais
O esporte de alto rendimento submete o organismo a níveis de esforços físicos aos quais, em condições do cotidiano, os sujeitos não vivenciarão. A probabilidade de instalação de quadros lesivos é uma constante na vida esportiva. A monitoração dos níveis de estresse oxidativo, através da dosagem de enzimas antioxidantes e de índices de desintegração de estruturas protéicas e lípídicas das membranas biológicas, permite estabelecer parâmetros de modulação das cargas de treino e, conseqüentemente, modulação da intensidade dos esforços.
Referências bibliográficas
-
ALESSIO HM. Exercise-induced oxidative stress. Medicine and Science in Sports and Exercise, v. 25, p. 218-224, 1993.
-
ANTUNES NETO, J. M. F. Modificações morfo-funcionais do tecido muscular induzidas pela atividade excêntrica: um estudo global dos processos adaptativos. Dissertação de Mestrado. Faculdade de Educação Física: Universidade Estadual de Campinas, 1998.
-
ÄSTRAND PO. Why exercise? Medicine and Science in Sports and Exercise, v. 24, p. 153-162, 1992.
-
ATALAY M, MARNILA P, LILIUS EM. Glutathione-dependent modulation of exhausting exercise-induced changes in neutrophil function in rats. European Journal of Applied Physiology, v. 74, p. 342-346, 1996.
-
BECKMAN JS, BECKMAN T, FREEMAN B. Apparent hydroxyl radical production by peroxynitrite: implications for endotelial injury from nitric oxide and superoxide. Proc. Natl. Acad. Scie. USA 1990; 87: 1620-1624.
-
BUCZYNSKY A, BLASZCZYK J, KEDZIORA J. Blood platelet superoxide dismutase activity and malonyldialdehyde concentrations in healthy men following 112 submaximal physical exercise. In: NAZAR, K., TERJUNG, R. L., USCILKO, H. K. et al. (orgs.). International perspectives in exercise physiology. Champaign: Human Kinetics, 1990.
-
CRISWELL D, POWERS S, DODD S, LAWLER J, EDWARDS W, RENSHLER K, GRINTON S. High intensity training-induced changes in skeletal muscle antioxidant enzyme activity. Medicine and Science in Sports and Exercise, v. 25, p. 1135-1140, 1993.
-
DAVIES KJA, QUINTANILHA AT, BROOKS GA, PACKER L. Free radicals and tissue damage produced by exercise. Biochemical and Biophysical Research Communications, v. 107, p. 1198-1205, 1982.
-
DEAN RT. A mechanism for accelerated degradation of intracellular proteins after limited damage by free radicals. FEBS Letter, v. 220, p. 278-282, 1987.
-
GOLDFARB AH. Antioxidants: role of supplementation to prevent exercise-induced oxidative stress. Medicine and Science in Sports and Exercise, v. 25, p. 232-236, 1993.
-
JENKINS RR, GOLDFARB A. Introduction: oxidative stress, aging, and exercise. Medicine and Science in Sports and Exercise, v. 25, p. 210-212, 1993.
-
JI LL, FU R, MITCHELL EW. Glutathione and antioxidant enzymes in skeletal muscle: effects of fiber type and exercise intensity. Journal of Applied Physiology, v. 73, p. 1854-1858, 1992.
-
JI LL, STRATMAN F, LARDY H. Antioxidant enzymes system in rat liver and skeletal muscle: influence of selenium deficiency acute exercise and chronic training. Archives of Biochemystry and Biophysic, v. 263, p. 150-160, 1988.
-
HALLIWELL B, GUTTERIDGE JM. Free radicals in biology and medicine. Oxford: Clarendon Press, 1989.
-
HELLSTEN Y, HANSSON HA, JOHNSON L. Increased expression of xanthine oxidade and insulin-like growth factor I (IGF-I) immunoreactivity in skeletal muscle after strenuous exercise in humans. Acta Physiologica Scandinavica, v. 157, p. 191-197, 1996.
-
LAUGHLIN MH, SIMPSON T, SEXTON WL, BROWN OR, SMITH JK, KORTHUIS RJ. Skeletal muscle oxidative capacity, antioxidant enzymes and exercise training. Journal of Applied Physiology, v. 68, p. 2337-2343, 1990.
-
LAWLER, J. M., CLINE, C. C., HU, Z. et al. Effect of oxidant challenge on contractile function of the aging rat diaphragm. American Journal of Physiology, v. 272, n. 02, p. E201-E207, 1997.
-
OHKAWA H, NOBUKO O, YAGI K. Assay for lipid peroxidation in animal tissues by thiobarbituric acid reaction. Analytical Biochemistry, v. 95, p. 351-358, 1979
-
POWERS SK, CRISWELL D, LAWLER J, JI LL, MARTIN D, HERB RA, DUDLEY G. Influence of exercise and fiber type on antioxidant enzyme activity in rat skeletal muscle. American Journal of Physiology, v. 266, p. R375-380, 1994.
-
POWERS SK, JI LL, LEEUWENBURGH C. Exercise training-induced alterations in skeletal muscle antioxidant capacity: a brief review. Medicine and Science in Sports and Exercise, v. 31, p. 987-997, 1999.
-
RADÀK Z, TAHARA S, NAKAMOTO H, OHNO H, SASVÁRI M, NYAKAS C, GOTO S. The effect of exercise training on oxidative damage of lipids, proteins and DNA in rat skeletal muscle: evidence for beneficial outcomes. Free Radical Biology & Medicine, v. 27, p. 69-74, 1999.
-
REID MB. Reactive oxygen and nitric oxide in skeletal muscle. News of Physiology and Science, v. 11, p. 114-119, 1996.
-
REID MB. Role of nitric oxide in skeletal muscle: synthesis, distribution and functional importance. Acta Physiologica Scandinavica, v. 162, p. 401-409, 1998.
-
REID MB. Redox modulation of skeletal muscle contraction: what we know and what we don’t. Journal of Applied Physiology, v. 90, p. 724-731, 2001.
-
REID MB, DURHAM WJ. Generation of reactive oxygen and nitrogen species in contracting skeletal muscle – potential impact on aging. Ann. N. Y. Acad. Sci., v. 959, p. 108-116, 2002.
-
RYAN TP, AUST SD. The role of iron in oxygen-mediated toxicities. Critical Reviews in Toxicology, v. 22, p. 119-141, 1992.
-
RYTER SW, PACIFICI RE, DAVIES KJA. Constitutive and inducible repair system in oxidative stress. In: Biological Oxidation Systems. New York: Academic Press, p. 929-952, 1990.
-
SEN C. Oxidants and antioxidants in exercise. Journal of Applied Physiology 1995; 79: 675-686.
-
SJÖDIN B, WESLING H, APPLE S. Biochemical mechanisms for oxygen free radical formation during exercise. Sports Medicine, v. 10, p. 236-254, 1990.
-
SJÖDIN B, WESTING YH. Changes in plasma concentration of hypoxanthine and uric acid in man with short-distance running at various intensities. International Journal of Sports and Medicine, v. 11, p. 493-495, 1990.
-
SMOLKA MB, ZOPPI CC, ALVES AA, SILVEIRA LR, MARANGONI S, PEREIRA-DA-SILVA L, NOVELLO JC, MACEDO DV. HSP72 as a complementary protection against oxidative stress induced by exercise in the soleus muscle of rats. American Journal of Physiology, v. 279, p. R1539-1545, 2000.
-
TIIDUS PM. Radical species in inflamation and overtraining. Canadian Journal of Physiology and Pharmacology 1998; 76: 533-538.
-
YAGI KA. A simple fluorimetric assay for lipoperoxide in blood plasma. Biochemistry and Medicine, v. 15, p. 212-216, 1976.
-
YU BP. Cellular defenses against damage from reactive oxygen species. Physiological Reviews, v. 74, p. 139-162, 1994.
Outros artigos em Portugués
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista Digital · Año 17 · N° 168 | Buenos Aires,
Mayo de 2012 |
|