
|
|||
|---|---|---|---|
|
|
O método de detecção de limiar de estresse oxidativo aplicada em jogadores profissionais de futebol El método de detección de umbral de estrés oxidativo aplicado en jugadores profesionales de fútbol The method of oxidative stress threshold detection applied in professional soccer players |
|
|
|
Instituto de Biologia, Departamento de Bioquímica Universidade Estadual de Campinas, UNICAMP (Brasil) |
Joaquim Maria Ferreira Antunes Neto Denise Vaz de Macedo |
|
|
|
Resumo O objetivo deste estudo foi detectar níveis de estresse oxidativo em jogadores profissionais de futebol de campo durante o Campeonato Brasileiro. Peroxidação lipídica, quantificada no plasma pelo método das substâncias reativas ao ácido tiobarbitúrico (TBARS), níveis em eritrócito das enzimas antioxidantes catalase (CAT) e glutationa redutase (GR) e grupamentos sulfidrílicos totais plasmáticos (GST) foram utilizados como indicadores de estresse oxidativo. Os níveis de lesões musculares foram medidos através da concentração de creatina quinase (CK) plasmática. O estresse imposto pelo treinamento físico e a competição leva a um aumento na produção de espécies reativas de oxigênio (EROs), as quais podem reagir com estruturas celulares afetando a homeostasia das mesmas. Contudo, o treinamento físico também atua modulando os sistemas antioxidantes intracelulares e, desta forma, aumentando a capacidade de desestruturar as EROs. Nossos dados mostraram que o programa de treinamento foi efetivo para elevar a atividade das enzimas antioxidantes, diminuindo o risco de lesões musculares induzidas pelo estresse oxidativo. Estes resultados possibilitam os profissionais envolvidos com manipulação da carga de treinamento restabelecer períodos recuperativos, prevenindo, assim, a instalação de overreaching (estresse metabólico). Unitermos: Futebol. Estresse oxidativo. Treinamento. Antioxidantes. Creatina quinase.
Abstract The aim of this study was to detect oxidative stress levels in professional soccer players during the Brazilian Soccer Champioship. Plasma lipid peroxidation, quantified by thiobarbituric acid reactive substances (TBARS), levels of erythrocyte antioxidant enzymes (catalase- CAT; glutathione reductase- GR) and plasma total sulphydryl groups (TSG) were used as indicators of oxidative stress. Muscle damage levels were measured through plasma creatine kinase (CK). The stress imposed by the physical training and the competition leads to an increase in reactive oxygen species (ROS) production that can react with cellular structures affecting cellular homeostasis. However physical training also acts modulating the intracellular antioxidant systems improving its capacity to detoxify ROS. Our data showed that the training program was effective to improve the antioxidant enzymes activity avoiding the possible risks of muscle oxidative stress induced damage. These results will allow professionals involved with load training manipulation to be concerned with the rest periods, preventing hence the installation of overreaching. Keywords: Soccer. Oxidative stress. Training. Antioxidants. Creatine kinase.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires, Año 16, Nº 159, Agosto de 2011. http://www.efdeportes.com |
|
|
1 / 1
Introdução
Os profissionais envolvidos com o monitoramento do treinamento dos atletas podem, hoje, utilizar como ferramenta de avaliação as análises de marcadores de estresse oxidativo (Antunes Neto, 2008; Antunes Neto et al., 2008). Além desta classe de estudos carecer de muitas respostas e pesquisas experimentais, há a dificuldade de integrar equipe científica e comissão técnica esportiva, pois, por se tratar de uma discussão de tecnologia inovadora para os padrões do esporte nacional, há a necessidade de adequação entre calendário competitivo, fases de treinamento e aprofundamento de grupos de estudos multidisciplinares.
A técnica de detecção de limiar de estresse oxidativo busca estabelecer o intervalo anterior de se instalar o desbalanço entre queda da atividade antioxidante e a precipitação de substâncias oxidativas tóxicas ao meio celular (Antunes Neto et al., 2006). As principais espécies radicalares de oxigênio (EROs) podem ser derivadas de fontes exógenas ou produzidas endogenamente como conseqüência normal das funções celulares, por diversas enzimas que utilizam o oxigênio (O2) como substrato (Finkel; Holbrook, 2000; Martindale; Holbrook, 2002; Finkel, 2003). Resultam da excitação do O2 para formar oxigênio singleto (1O2) ou da redução do O2, nas mitocôndrias, pela citocromo oxidase (aa3) – que catalisa a transferência de um, dois e três elétrons – originando, respectivamente, radical superóxido (O2-), peróxido de hidrogênio (H2O2) e radical hidroxila (OH). Este processo de redução produz água (H2O) como produto final da reação (Gutteridge, 1995; Sies, 1997; Antunes Neto et al., 2005).
As principais EROs dividem-se em radicalares e não radicalares. Podem, ainda, reagir com outros átomos e formar espécies reativas, como o peroxinitrito (OONO-) – formado a partir da reação do óxido nítrico (NO) com O2- (GIASSON et al., 2002). Algumas destas espécies são extremamente instáveis, enquanto outras são livremente difusas e de meia-vida relativamente longa (FINKEL; HOLBROOK, 2000). Por serem extremamente reativas, níveis elevados ou sustentados de EROs podem causar danos severos ao DNA (deleções, mutações e translocações; além de oxidação de filamentos), às proteínas (modificações locais específicas nos aminoácidos, fragmentação da corrente do peptídeo e aumento da susceptibilidade da proteólise) e aos lipídios (alterações em propriedades de membranas biológicas) (MARTINDALE; HOLBROOK, 2002; SCANDALIOS, 2005; ANAZETTI, MELO, 2007). Tais circunstâncias podem conduzir à necrose ou apoptose, além de sinalização para ativação gênica de eventos patológicos que até então estavam “dormentes” (Anazetti; Melo, 2007).
A fim de minimizar os efeitos das EROs, organismos aeróbios desenvolveram mecanismos de defesa antioxidante (Finkel, 2003; Scandalios, 2005). Antioxidante é qualquer substância que, quando presente em concentrações mais baixas que a do substrato oxidável, é capaz de atrasar ou inibir significativamente a oxidação do mesmo (Gutteridge; Halliwell, 1994). Para tanto, previnem a formação destas espécies; interceptam-nas assim que formadas; reparam o dano oxidativo ocasionado por elas; aumentam a eliminação das moléculas danificadas e aumentam a eliminação também das não excessivamente danificadas, para minimizar a formação de mutações (GUTTERIDGE, 1995).
Os sistemas de defesa antioxidante são divididos em não enzimático (SANE) e enzimático (SAE). Fazem parte do SANE pequenas moléculas como vitaminas C e E, flavonóides, selênio, bilirrubina, ácido úrico e carotenóides, derivadas principalmente da alimentação (Wiseman; Halliwell, 1996; Nordberg; Arnér, 2001; Scandalios, 2005). O SAE é constituído principalmente por três enzimas: Superóxido Dismutase (SOD); Catalase (CAT) e Glutationa Peroxidase (GPx). Estas enzimas oferecem proteção ao organismo através da remoção do radical superóxido (O2-) e do peróxido de hidrogênio (H2O2), convertendo-os em espécies menos reativas (Finkel, 2003; Scandalios, 2005). A SOD catalisa a reação de conversão do radical superóxido em peróxido de hidrogênio e oxigênio, enquanto que a CAT e a GPx – esta juntamente com a Glutationa Redutase (GR) – são responsáveis pela redução do peróxido de hidrogênio em água e oxigênio (Gutteridge, 1995; Scandalios, 2005).
Em nosso estudo, analisaremos a atividade da CAT, bem como das substâncias reativas ao ácido tiobarbitúrico (TBARS), grupamentos sulfidrila totais (GST) e enzima creatina quinase (CK). Por ser responsável pela redução das moléculas de H2O2, a CAT é uma enzima principal e estrategicamente situada nos peroxissomas – local nos quais se localizam as enzimas produtoras deste substrato -, podendo, assim, exercer sua função antes da difusão do H2O2 para as demais células. Esta enzima também é responsável pela detoxificação de outros substratos, como fenóis e alcoóis, e é capaz de decompor milhares de moléculas de H2O2 por minuto – sendo considerada um dos catalisadores mais ativos produzidos pela natureza (SCANDALIOS, 2005). Já, os grupamentos sulfidrila são compostos que possuem grande importância no sistema antioxidante por oferecerem suas ligações (–SH) a Glutationa (GSH), auxiliando, portanto, na atenuação das respostas de estresse oxidativo (FAURE; LAFOND, 1995).
A análise da formação de substâncias reativas ao ácido tiobarbitúrico (TBARS) é o principal método para quantificar os produtos finais da peroxidação lipídica, que nada mais é do que a oxidação do radical livre de ácidos graxos poliinsaturados nos sistemas biológicos, utilizada para mensurar o estresse oxidativo de tecidos e células (Gutteridge, 1995; Scoccia et al., 2001). A concentração plasmática de CK é um forte indicativo da severidade do exercício físico e seu efeito nos tecidos. Aumento nos níveis desta enzima provoca seu extravasamento para o sangue devido à perda da integridade da membrana celular (CHEVION et al., 2003), correlacionando-se com o ataque oxidativo, uma vez que distúrbios originados pelas EROs podem induzir microlesões e aumento de permeabilidade das membranas biológicas (ANTUNES NETO et al., 2006).
Durante o Campeonato Brasileiro de Futebol de 2001 realizamos cinco coletas de sangue em todo o elenco de jogadores da Associação Atlética Ponte Preta, sendo a primeira coleta no período pré-competitivo (julho) e as outras quatro coletas ao longo do campeonato (agosto, setembro, outubro, novembro). O objetivo deste monitoramento junto aos jogadores de futebol da categoria profissional foi testar a aplicabilidade da técnica de limiar de estresse oxidativo. Dentro dos princípios da nossa técnica, em momentos distintos do campeonato, realizamos monitoramento individualizado de alguns jogadores, por estes apresentarem valores de certos parâmetros muito diferentes do restante do grupo. Neste momento de detecção da alteração dos parâmetros bioquímicos, os jogadores tiveram a carga de esforço diminuída e o tempo de recuperação aumentado por duas semanas, sendo reavaliados novamente ao final dessas semanas. Com isso, após os resultados das análises sangüíneas, foi possível individualizar e corrigir as cargas de treinamento e tempo de recuperação daqueles atletas detectados em limiar de estresse, permitindo que todo o grupo alcançasse uma adaptação positiva, sem a ocorrência de lesões musculares mais graves
Materiais e métodos
Sujeitos
Participaram do estudo 18 jogadores profissionais de futebol de campo, da Associação Atlética Ponte Preta, com idade média de 23,6 ± 3,5 anos. Todos os voluntários assinaram o Termo de Consentimento Livre e Esclarecido de participação da pesquisa, após aprovação do Comitê de Ética em Pesquisa com Humanos da Faculdade de Odontologia da Universidade Estadual de Campinas (UNICAMP). Os voluntários foram informados sobre todos os procedimentos utilizados e deram seu consentimento por escrito.
Treinamentos executados durante a fase pré-competitiva e competitiva
Na fase pré-competitiva do Campeonato Brasileiro de Futebol de Campo, os jogadores encontravam-se de um período de transição da competição passada. Consideramos, portanto, que o condicionamento atlético e os níveis dos marcadores bioquímicos a serem avaliados não estavam totalmente em condição controle, mas que poderiam ser utilizados como tal, uma vez que o Campeonato era longo e as exigências severas. No período competitivo, a tendência era que os atletas treinassem quatro dias da semana, executando atividades técnicas, físicas e táticas. A intensidade das sessões de treino não superava a 60% da carga máxima para cada atividade e o volume de treino não ultrapassava 120 minutos. Configuravam-se atividades de média intensidade, cujo objetivo visava a manutenção da forma adquirida no período preparatório. Os jogadores realizavam, no período competitivo, até 2 jogos, os quais tinham que se deslocar, muitas vezes, para longas distâncias.
Preparo das amostras
Foram coletados 5 mL de sangue da veia antecubital, em tubos VACUETTE® descartáveis contendo EDTA. As coletas foram realizadas com todos os cuidados de assepsia necessários. Após a centrifugação do sangue total – por 10 minutos a 2500 rpm – o plasma foi obtido e congelado em eppendorfs. As hemácias foram lavadas com solução gelada de tampão fosfato para catalase e centrifugadas a 2500 rpm, desprezando-se o sobrenadante. Este procedimento foi realizado três vezes. Em seguida, foram misturadas com água destilada na proporção 1:1 (250 µL de hemácias:250 µL de água destilada) para formação do hemolisado 1:1, posteriormente congelado em eppendorfs.
Análises bioquímicas
Dosagem de Hemoglobina (Hb). A determinação da concentração de Hb no hemolisado é fundamental para a obtenção dos valores finais da atividade da enzima catalase. As amostras foram preparadas adicionando-se 2 mL de reagente de Drabkin (10% KCN, 30% K4[Fe(CN)6]) a 100 µL de hemolisado 1:20 (50 µL de hemolisado 1:1 + 250 µL de água destilada + 50 µL de tampão para glutationa). A concentração de Hb foi obtida através do método de Drabkin (BEUTLER, 1975); no qual a Hb, em presença do reagente, forma um composto – a cianometahemoglobina – determinado em espectrofotômetro a 540 nm, zerado com tubo branco contendo 2 mL de reagente de Drabkin. Os resultados foram expressos em mg/mL.
Marcadores Antioxidantes
Catalase (CAT). As amostras foram preparadas adicionando-se 1 mL do meio de reação para catalase a 10 µL do hemolisado 1:20 (o mesmo utilizado para as análises de Hb). As leituras foram realizadas no tempo zero e após 15 segundos, a 240 nm, em espectrofotômetro zerado com tubo branco contendo 1 mL de tampão fosfato para catalase. A concentração foi obtida através da velocidade com que o H2O2 foi reduzido pela ação da enzima, provocando uma diminuição no valor da absorbância (AEBI, 1984). Os resultados foram expressos em k/gHb/min.
Glutationa Redutase (GR). O ensaio era conduzido de acordo com Smith et al (1988). A preparação da amostra dava-se da mesma forma para a análise de CAT, com a a diluição 1:20 do hemolisado armazenado a - 80° C. Deste hemolisado, 5 μL era adicionado a um meio de incubação contendo KH2PO4 0,2 M e EDTA 2 mM, em pH 7,0. Adicionávamos ainda, para a ocorrência da reação, 50μL de NADPH 2 mM, 250μL de DTNB 3 mM e 50μL de GSSG 20 mM. A formação de TNB era acompanhada por espectrofotômetro (Beckman - modelo DU 640) a 412 nm de absorvância. O princípio do método é baseado na redução do 5,5-ditiobis (2-ácido nitrobenzóico), DTNB, com conseqüente aumento de TNB:
GSSG + NADPH + H+ → 2GSH + NADP+
GSH + DTNB → GSTNB + TNB
Para calcular a atividade da GR, utilizamos a seguinte equação: E = 100 x A/[Hb], onde E é a atividade da enzima em unidades internacionais (UI)/gHb, A é o número de unidades de enzima da amostra, sendo calculada pela equação: ΔA/13,6 x Vh/Vc (onde ΔA é a diferença da absorbância a 412 nm em 1 minuto, 13,6 é o coeficiente de extinção do TNB a 412 nm, Vh é o volume de hemolisado na cubeta, Vc é o volume total da solução) e [Hb] é a concentração de hemoglobina do hemolisado em g/dL (Beatler, 1975). A unidade final expressa-se em UI/gHb/min.
Grupamentos Sulfidrila Totais (GST). A primeira leitura (A1) foi realizada adicionando-se 1 mL de tampão TRIS-EDTA a 50 µL de plasma, em espectrofotômetro a 412 nm zerado com tubo branco contendo 1 mL de tampão TRIS-EDTA. Em seguida, foram adicionados 20 µL de DTNB e esta mistura foi incubada por 15 minutos ao abrigo da luz. A segunda leitura (A2) foi novamente realizada em espectrofotômetro a 412 nm, porém desta vez zerado com tubo branco contendo 1 mL de tampão TRIS-EDTA e 20 µL de DTNB (HU, 1994). A concentração de GST foi obtida através da fórmula: GST = (A2 - A1 - Branco) × 1,57 × 1000 e os resultados expressos em µM (HU, 1994).
Marcadores oxidantes
Substâncias Reativas ao Ácido Tiobarbitúrico (TBARS). Os produtos finais da peroxidação lipídica (peróxidos lipídicos, malondialdeídos e demais aldeídos de baixo peso molecular), ao reagirem com o ácido 2-tiobarbitúrico (TBA), formam Bases de Schiff. Tais complexos são coloridos e sua concentração pode ser determinada espectrofotometricamente a 535 nm, ou por fluorescência a 515 nm de excitação e 555 nm de emissão (YAGI, 1976). A concentração de TBARS foi obtida por meio de uma curva-padrão de tetraetoxipropano e os resultados expressos em nmol/mL de plasma.
Marcadores de alteração celular
Creatina Quinase (CK). A dosagem foi realizada por método Cinético – UV, através do kit CAT Nº 01300 da Laborlab®; seguindo-se as instruções do fabricante: em uma cubeta, 1 mL do reativo de trabalho ficou incubado por 3 a 4 minutos para posterior mistura com 20 µL de plasma (amostra). Após 3 minutos, a absorbância inicial foi determinada e o cronômetro disparado, para determinação das absorbâncias após os exatos 1, 2 e 3 minutos seguintes. A concentração foi obtida através da fórmula: CK = ∆A/minuto x 8095, onde ∆A/minuto corresponde à subtração de cada leitura anotada da anterior e posterior média dos valores (∆A/minuto = [(A3 - A2) + (A2 - A1) + (A1 - A0)] ÷ 3). Os resultados foram expressos em U/L.
Tratamento dos dados e análises estatísticas
O “box plot” ordena os dados pela mediana e os divide em quartis. Ou seja, acima e abaixo da mediana encontram-se 50% dos dados obtidos, 25% acima da mediana e 25% abaixo dela e as duas linhas tracejadas representam os 50% dos valores mais distantes. Os dados que se diferenciam extremamente do comportamento geral são colocados para fora dos quartis e são chamados de “outliers” ou valores extremos. Optamos por apresentar os resultados obtidos na forma de “box plot” por entendermos que esse tipo de gráfico descreve melhor o comportamento do grupo frente às várias situações de exercício, permitindo uma melhor visualização da variabilidade dos dados. O interessante desta forma de apresentação gráfica é a possibilidade de poder visualiar a disposição de todo o grupo, conseguindo, assim, situar a maior concentração dos resultados. As análises estatísticas foram determinadas através do programa GraphPad Instat®. Para amostras pareadas foi utilizado o teste ANOVA e, como pós-teste, o Teste de Tukey. Valores de p<0.05 foram considerados estatisticamente significativos
Resultados
Marcador de alteração muscular
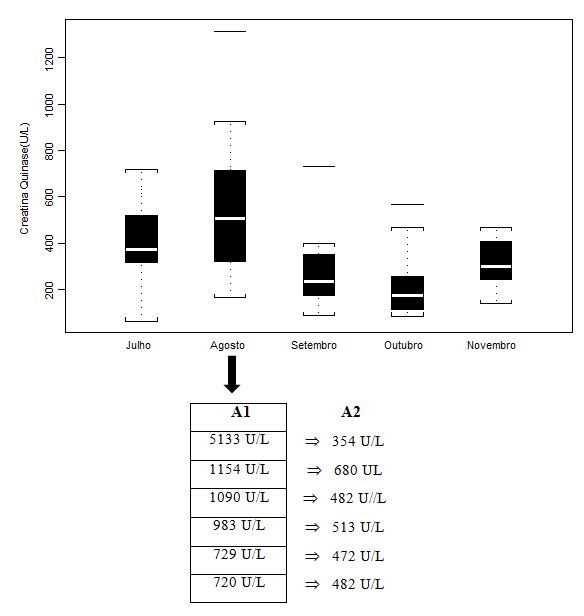
Figura 1. Concentração plasmática de Creatina Quinase (CK; U/L) dos jogadores de futebol durante o pré-campeonato (julho) e ao longo de quatro momentos do Campeonato
Brasileiro (agosto, setembro, outubro e novembro), apresentada em mediana (box plot e outliers). Onde: A1 = valores individuais dos jogadores que
extrapolaram abruptamente a mediana do grupo; A2 = valores individuais dos jogadores após duas semanas de treinamento recuperativo.
Os valores médios, quando avaliados por tratamentos estatísticos próprios, não apresentaram diferenças significativas (p>0.05) ao longo da fase pré-competitiva e do campeonato. Se comparadas ao valor controle - para tanto, utilizamos dados de Antunes Neto e colaboradores (2007c), os quais avaliaram sujeitos adultos saudáveis não atletas. Neste estudo, para o parâmetro CK, o resultado foi 130 ±100 U/L, de forma que todos os 5 momentos tiveram aumento significativo (p<0.05), muito em virtude do estresse muscular imposto pelo treinamento. Importante salientar que, com a dispersão dos dados quando apresentados em box plot, tais análises não permitem a compreensão da condição de alteração do sujeito para o parâmetro estudado. Portanto, os valores de A1 (n=6) foram aqueles individualizados e discutidos com a comissão de preparação física, com o intuito de promover a estratégia de recuperação; já, os valores em A2 mostram que o mesociclo de 2 semanas de treinamento recuperativo possibilitou queda importante para minimazação do estresse muscular.
Marcadores enzimáticos antioxidantes
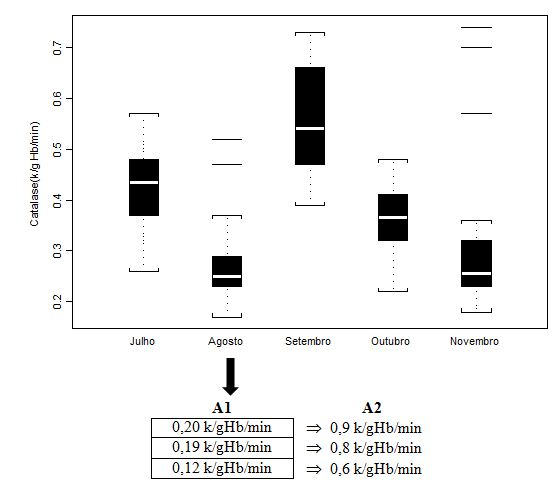
Figura 2. Concentração em hemolisado da enzima Catalase (CAT; k/gHb/min) dos jogadores de futebol durante o pré-campeonato (julho) e ao longo de quatro
momentos do Campeonato Brasileiro (agosto, setembro, outubro e novembro), apresentada em mediana (box plot e outliers). Onde: A1 = valores individuais
dos jogadores que extrapolaram abruptamente a mediana do grupo; A2 = valores individuais dos jogadores após duas semanas de treinamento recuperativo.
Os valores médios, quando avaliados por tratamentos estatísticos próprios, distintos da mediana, não apresentaram diferenças significativas (p>0.05) ao longo da fase pré-competitiva (julho) e do campeonato (demais análises). Se comparadas ao valor controle - para tanto, utilizamos dados de Antunes Neto e colaboradores (2007c), os quais avaliaram sujeitos adultos saudáveis não atletas. Neste estudo, o resultado do parâmetro CAT foi 0,37 ± 0,02 k/gHb/min, de forma que apenas na análise de setembro houve aumento sifnigicativo (p<0.01) comparando-se os valores controle entre os demais e entre os cinco momentos. Importante salientar que, com a dispersão dos dados quando apresentados em box plot, tais análises não permitem a compreensão da condição de alteração do sujeito para o parâmetro estudado. Portanto, os valores de A1 (n=3) foram aqueles individualizados e discutidos com a comissão de preparação física, com o intuito de promover a estratégia de recuperação; já, os valores em A2 mostram que o mesociclo de 2 semanas de treinamento recuperativo possibilitou queda importante para minimização do estresse muscular.
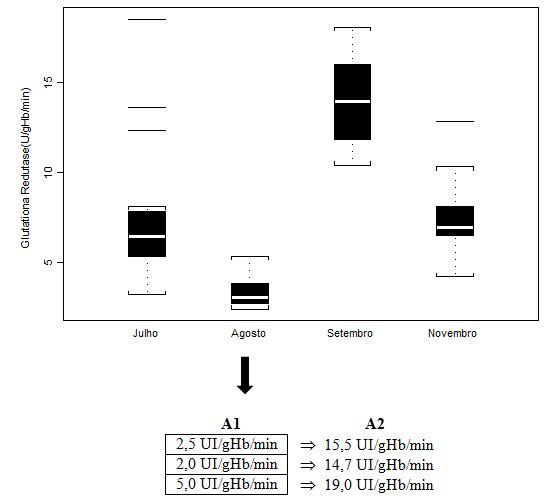
Figura 3. Concentração em hemolisado da enzima Glutationa Redutase (UI/gHb/min) dos jogadores de futebol durante o pré-campeonato (julho) e ao longo de quatro momentos do
Campeonato Brasileiro (agosto, setembro, outubro, novembro), apresentada em mediana (box plot e outliers). Onde: A1 = valores individuais dos jogadores que extrapolaram
abruptamente a mediana do grupo; A2 = valores individuais dos jogadores após duas semanas de treinamento recuperativo. Observação: a análise de outubro não foi realizada
para tal parâmetro, por ausência suficiente de amostra.
O valor médio controle obtido por Antunes Neto e colaboradores (2007c) para o parâmetro Glutationa Redutase (8,3±0,7) apresentou diferenças significativas (p<0.01) quando comparados aos resultados obtidos nas análises de setembro e novembro em relação aos demais (julho e agosto). Importante salientar que, com a dispersão dos dados quando apresentados em box plot, tais análises não permitem a compreensão da condição de alteração do sujeito para o parâmetro estudado. Portanto, os valores de A1 (n=3) foram aqueles individualizados e discutidos com a comissão de preparação física, com o intuito de promover a estratégia de recuperação; já, os valores em A2 mostram que o mesociclo de 2 semanas de treinamento recuperativo possibilitou queda importante para minimazação do estresse muscular.
Marcador não enzimático antioxidante
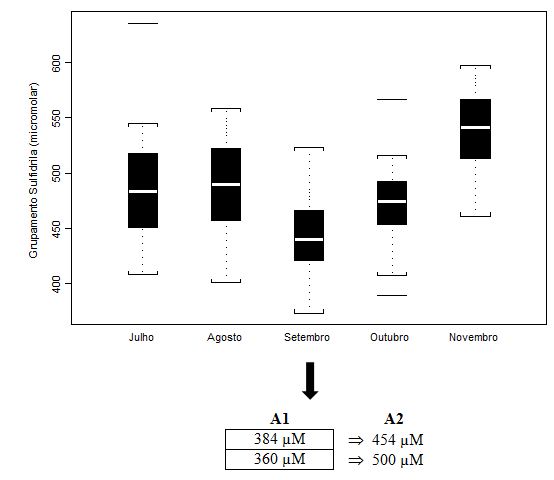
Figura 4. Concentração plasmática de Grupamentos Sulfidrila (µM) dos jogadores de futebol durante o pré-campeonato (julho) e ao longo de quatro momentos do Campeonato
Brasileiro (agosto, setembro, outubro e novembro), apresentada em mediana (box plot e outliers). Onde: A1 = valores individuais dos jogadores que extrapolaram
abruptamente a média do grupo; A2 = valores individuais dos jogadores após duas semanas de treinamento recuperativo.
A análise de setembro apresenta os valores medianos mais baixos para o parâmetro do grupamento sulfidrila total (µM). Antunes Neto e colaboradores (2007c) obtiveram valores médios controle de 500 ± 100µM. Apesar de não obtivermos diferença estatística para tal parâmetro, isso reflete a dispersão observada nas ilustrações esquematizadas em mediana e blox plot. Os valores de A1 (n=2) foram aqueles individualizados e discutidos com a comissão de preparação física, com o intuito de promover a estratégia de recuperação; já, os valores em A2 mostram que o mesociclo de 2 semanas de treinamento recuperativo possibilitou queda importante para minimazação do estresse muscular.
Marcador de ataque oxidativo
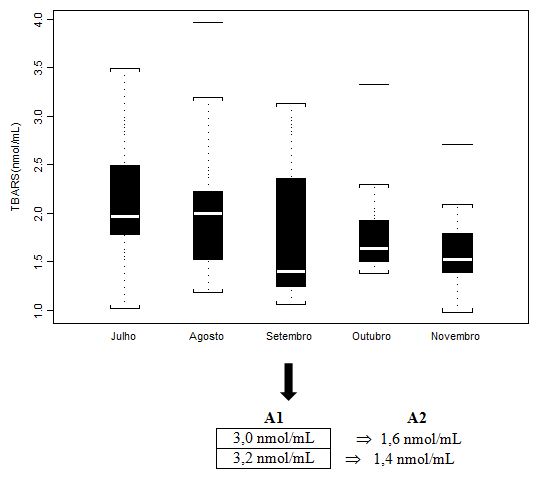
Figura 5. Concentração plasmática de Substâncias Reativas ao Ácido Tiobarbitúrico (µM) dos jogadores de futebol durante o pré-campeonato (julho) e ao longo de quatro
momentos do Campeonato Brasileiro (agosto, setembro, outubro e novembro), apresentada em mediana (box plot e outliers). Onde: A1 = valores individuais dos
jogadores que extrapolaram abruptamente a mediana do grupo; A2 = valores individuais dos jogadores após duas semanas de treinamento recuperativo.
Os valores obtidos para TBARS, ao serem analisados por mediana, box plot e otliers, deixam claro a dispersão e heterogeneidade do grupo, com resultados individuais três vezes mais elevados entre os participantes do estudo, considerando box plot e outliers. Antunes Neto e colaboradores (2007c) obtiveram para um grupo controle, adultos jovens, praticantes de atividades físicas, a média de 1,12± 0,02 µM. Portanto, os valores de A1 (n=2) foram aqueles individualizados e discutidos com a comissão de preparação física, com o intuito de promover a estratégia de recuperação; já, os valores em A2 mostram que o mesociclo de 2 semanas de treinamento recuperativo possibilitou queda importante para minimazação do estresse muscular.
Discussão
Como mostrado, as EROs são formadas, principalmente, pela redução incompleta do oxigênio nos processos de geração de energia. O oxigênio consumido tem como principal via de metabolismo o sistema aeróbio, ou seja, a mitocôndria (Jenkins; Goldfarb, 1993). Esse sistema responsabiliza-se pela utilização de 85% a 90% de todo o oxigênio consumido, sendo os outros 10% a 15% utilizados por enzimas oxidases e oxigenases e por reações químicas de oxidação direta. Dos 85% a 90% de oxigênio que chegam a cadeia de transporte de elétrons, 2 a 5% são reduzidos unilateralmente em metabólitos, tal como as EROs (Schneider; Oliveira, 2004). Durante a atividade física, o consumo de oxigênio pode aumentar até 20 vezes e sua captação pelos músculos ativos pode aumentar até 100 vezes, favorecendo, dessa maneira, a formação de EROs (ANTUNES NETO et al., 2005). O estresse oxidativo ocorre em circunstancias nas quais ha desequilíbrio entre os sistemas prooxidantes e antioxidantes, de maneira que os primeiros sejam predominantes (ANTUNES NETO et al., 2008). Dentro de uma estratégia de manutenção do estado redox contra condições oxidantes, o sangue exerce um papel fundamental, fazendo o transporte e redistribuição dos antioxidantes para todo o corpo; dessa maneira, a capacidade antioxidante no sangue pode nos dar estimativas dos níveis de estresse oxidativo, permitindo um modo de mensuração menos invasivo que por outras vias, como pela biopsia (ANTUNES NETO et al., 2006).
A análise dos dados sugere que a fase preparatória ou pré-competitiva (análise julho) e o início do campeonato (análise agosto) foram os momentos que apresentaram um maior nível de estresse, decorrentes, sobretudo, dos estímulos do treinamento na pré-temporada e início dos jogos da competição. A concentração plasmática de CK, sobretudo na análise agosto, mostra uma maior elevação e dispersão para este parâmetro (Figura 1). Neste momento, o treinamento físico estava com progressão da sobrecarga, com grande enfoque para os exercícios de força. Estímulos de força podem induzir alterações em estruturas do sarcômero (Thompson; Rilley, 1996), gerando processos inflamatórios secundários e processos degradativos posteriores (GIBALA et al., 1995). Uma hipótese aceita é que a ação de macrófagos e demais fatores inflamatórios podem vir a gerar produção localizada de EROs, aumentando, portanto, os níveis de estresse oxidativo (HELLSTEN et al., 1997; SUZUKI et al., 1996).
As análises para CK, em agosto (Figura 1), detectaram seis jogadores que se encontravam em níveis bem superiores aos vistos na mediana do grupo. O resultado relevante foi mostrar que duas semanas de exercícios recuperativos aeróbios de baixa intensidade, periodizados exclusivamente para os jogadores em questão, tiveram efeito benéfico altamente significativo para retorno a valores considerados aceitáveis para jogadores de futebol de campo. Resultados recentes de Lazarim e colaboradores (2009) estabeleceram como valor limite de referência, para níveis de extravasamento plasmático de CK, em jogadores profissionais de futebol de campo, o índice de 975 U/L. Tal limite permite compreender se o jogador encontra-se na transição entre estresse metabólico (“overreaching”) ou para um quadro mais agravante, o “overtraining” (KUIPERS, 1998).
Um ponto importante a ser notado é que a atividade das enzimas antioxidantes sofreu decréscimo na análise agosto, tanto para CAT quanto para GR (Figuras 2 e 3, respectivamente), o que nos sugere que a condição de treinamento intenso e os níveis de sobrecarga do início do campeonato não permitiram neste momento uma regulação positiva. Porém, considerando que o sistema antioxidante enzimático é integrado, os valores obtidos para ambas as enzimas, ao decorrer do campeonato, tiveram elevação projetiva e que extrapola níveis aferidos para grupo controle (ANTUNES NETO et al., 2007a; ANTUNES NETO et al., 2007b; ANTUNES NETO et al., 2007c). Da mesma forma relatada nos procedimentos desenvolvidos para jogadores com níveis elevados de CK, três outros jogadores tiveram carga de treinamento individualizada, durante duas semanas, ao encontrarmos atividade enzimática antioxidante incompatível com o padrão de estresse muscular imposto pelo treinamento e competição (Figuras 2 e 3). Indo de acordo com a literatura (ARAUJO et al., 2010), exercícios aeróbios possibilitaram aumento das enzimas estudadas. A sistematização do treinamento induz respostas moleculares intracelulares capazes de alterar o estado redox celular, o que pode ser a chave de desencadeamento dos eventos adaptativos bioquímicos (JI, 2002).
Quando se obtêm valores abaixo da mediana e mesmo próximo de outliers para algum parâmetro, tal condição não significa necessariamente que a organização e planejamento das atividades da periodização não estavam condizentes com a capacidade física dos jogadores. Considerando o treinamento físico uma condição exógena de estresse, a aplicação de estímulos estressores, representados pela intensidade, duração e freqüência do exercício físico, deve sempre buscar a alteração da homeostasia dos sistemas biológicos de maneira controlada e consistente com as possibilidades de adaptação do indivíduo (FRY et al., 1992). Quando se discute sobre os mecanismos de adaptação dos sistemas biológicos, deve ficar claro que há eventos que emitem respostas a curto prazo e eventos que necessitam de um maior tempo de interação dos fatores para que o organismo possa gerar alguma forma de adaptação (RIETVELD, 1996). Tal atividade biológica pode ser entendida como um ajuste regulatório, cujo objetivo é solucionar uma condição momentânea de perturbação: ajustes regulatórios não levam, necessariamente, a alterações morfológicas e funcionais duradouras (FRY et al., 1992). A supercompensação dos substratos metabólicos é um exemplo de ajuste regulatório, pois pode ocorrer a curto prazo, de uma sessão de treino para outra.
Nossos resultados mostram o caráter regulatório e estimulador para a célula ultrapassar a um novo patamar de resistência ao estresse oxidativo. Tal consideração é justificada quando observamos os resultados das análises de setembro, a qual ocorreu 33 dias após a análise de agosto. Neste período, obtivemos o maior aumento da atividade das enzimas antioxidantes (CAT e GR, Figuras 2 e 3, respectivamente) e decréscimo nos níveis plasmáticos de CK (Figura 1), sugerindo-nos a assimilação pelos atletas das cargas de esforço durante o treinamento e jogos. Por outro lado, a tendência de queda na concentração plasmática de grupamento sulfidrila neste mesmo período (GS, Figura 4) pode ser um indicativo de que as enzimas antioxidantes imperaram nos eventos de defesa ao estresse oxidativo. Conseguinte, com a elevação significativa da concentração de GS (Figura 4) na análise de novembro, evidencia-se o potencial adaptativo para que se estabeleçam níveis baixos e compactos de peroxidação lipídica (TBARS, Figura 5) nas fases que antecederam as finais do Campeonato (outubro e novembro).
Nesta perspectiva de ajuste regulatório, as análises indicaram que, durante o Campeonato, os atletas mantiveram-se em condições adequadas para evitar a ocorrência de um quadro de estresse oxidativo. Nossa interpretação é que os estímulos induzidos pelo treinamento e pela própria competição provocaram uma adaptação no sistema de defesa antioxidante, o que evitou a instalação de processos oxidativos mais severos (CHEVION et al., 2003). A queda na defesa enzimática antioxidante no final do Campeonato pode ser um reflexo do acúmulo de jogos neste período e da própria rotina de treinamentos. Contudo, ao analisarmos os marcadores de alteração muscular e ataque oxidativo neste momento, percebemos que não há indícios significativos de elevação, o que vem a confirmar que os jogadores encontravam-se bem adaptados aos níveis de estresse oxidativo aos quais estavam sendo submetidos.
Considerações finais
Nossa metodologia para detecção do limiar de estresse permitiu compreender o estágio de estresse de cada jogador em relação a ele mesmo e a toda a equipe, de forma que o preparador físico, de posse destes resultados, pudesse individualizar as cargas de treinamento e otimizar a recuperação de eventuais processos de lesões musculares. O sucesso só pode ser estabelecido quando há uma integração entre os pesquisadores e a comissão técnica esportiva, como aconteceu durante esse trabalho. As discussões estabelecidas mostraram-se produtivas, podendo o fruto delas ser observado nos resultados experimentais obtidos e na classificação da equipe para a fase final do Campeonato.
Referências bibliográficas
-
AEBI, H. Catalase. In: Methods in Enzymology. Packer L, editor. Florida: Academic Press, v. 105, p. 121-126, 1984.
-
ANAZETTI, M. C.; MELO, P. S. Morte celular por apoptose: uma visão bioquímica e molecular. Metrocamp Pesquisa, v. 01, n. 01, p. 37-58, 2007.
-
ANTUNES NETO, J. M. F. Estudo de marcadores de estresse oxidativo em um triatleta durante o período competitivo. Movimento & Percepção, v.9, p.31-46, 2008.
-
ANTUNES NETO, J. M. F. et al. Cinética de marcadores de estresses oxidativo e fisiológico em condição de corrida exaustiva. Revista Brasileira de Educação Física, Esporte, Lazer e Dança, v.02, p.56 - 68, 2007a.
-
ANTUNES NETO, J. M. F. et al. Manutenção de microlesões celulares e respostas adaptativas a longo prazo no treinamento de força. Brazilian Journal of Biomotricity, v.1, p.87 - 102, 2007b.
-
ANTUNES-NETO, J. M. F. et al. Circulating leukocyte heat shock protein 70 (HSP70) and oxidative stress markers in rats after a bout of exhaustive exercise. Stress, v. 09, n. 02, p. 107-115, 2006.
-
ANTUNES NETO, J. M. F. et al. Biomarcadores de estresse oxidativo: novas possibilidades de monitoramento em treinamento físico. Revista Brasileira de Ciência e Movimento, v. 13, p. 73-80, 2005.
-
ANTUNES NETO, J. M. F. et al. Oxidative stress monitoring in volleyball players during a championship. Revista Brasileira de Educação Física, Esporte, Lazer e Dança, v. 02, n. 03, p. 92-101, 2007c.
-
ANTUNES NETO, J. M. F. et al. Proteínas de estresse “HSP70” atuam como marcadoras de estresse oxidativo em ratos “wistar” submetidos a treinamento intermitente de corrida para indução de overreaching. Brazilian Journal of Biomotricity, v. 02, n. 03, p. 160-175, 2008.
-
ARAUJO, M. B. et al. Treinamento em diferentes intensidades e biomarcadores de estresse oxidativo e do metabolismo glicídico musculoesquelético de ratos. Revista da Educação Física, v. 21, n. 04, p. 695-704, 2010.
-
BEUTLER, E. Red cell metabolism. In: A Manual of Biochemical Methods. London: Grune & Stratton Publishers, 1975.
-
CHEVION et al. Plasma antioxidant status and cell injury after severe physical exercise. Proceedings of the National Academy of Sciences, v. 100, n. 09, p. 5119-5123, 2003.
-
FAURE, P.; LAFOND, J. L. Measurement of plasma sulphydryl and carbonyl groups as a possible indicator of protein oxidation. In: FAVIER, A. E. et al. (Eds.). Analysis of Free Radicals in Biological Systems. Basel: Birkhäuser Verlag, p. 237-248, 1995.
-
FINKEL, T. Oxidant signals and oxidative stress. Current Opinion in Cell Biology, v. 15, p. 247-254, 2003.
-
FINKEL, T.; HOLBROOK, N. J. Oxidants, oxidative stress and the biology of ageing. Nature, v. 408, 2000.
-
FRY, R. W. et al. Periodisation of training stress - a review. Canadian Journal of Sports and Science, v. 17, n. o3, p. 234-240, 1992.
-
GIASSON, B. I. et al. Q. The relationship between oxidative/nitrative stress and pathological inclusions in Alzheimer’s and Parkinson’s Diseases. Free Radical Biology and Medicine, v. 32, n. 12, p. 1264-1275, 2002.
-
GIBALA, M. J. et al. Changes in human skeletal muscle ultrastructure and force prodution after acute resistance exercise. Journal of Applied Physiology, v. 78, n. 02, p. 702-708, 1995.
-
GUTTERIDGE, J. M. C. Lipid peroxidation and antioxidants as biomarkers of tissue damage. Clinical Chemistry, v. 41, n. 12, p.1819 -1828, 1995.
-
GUTTERIDGE, J. M. C.; HALLIWELL, B. Antioxidants in nutrition, health, and disease. Oxford: 1994.
-
HELLSTEN, Y. et al. Xanthine oxidase in human skeletal muscle following eccentric exercise: a role in inflammation. Journal of Physiology, v. 498, part 1, p. 239-248, 1997.
-
HU, M. L. Measurement of protein thiol groups and glutathione in plasma. Methods in Enzymology, v. 233, p. 381-383, 1994.
-
JENKINS, R. R.; GOLDFARB, A. Introduction: oxidative stress, aging, and exercise. Medicine and Science in Sports and Exercise, v. 25, n. 02, p. 210-212, 1993.
-
JI, L. L. Exercise-induced modulation of antioxidant defense. Annals of the New York Academy of Science, v. 459, p. 82 - 92, 2002.
-
KUIPERS, H. Training and overtraining: an introduction. Medicine and Science in Sports and Exercise, v. 30, n. 07, p. 1137-1139, 1998.
-
LAZARIM, F., L. et al. The upper values of plasma creatine kinase of professional soccer players during the Brazilian National Championship. Journal of Science and Medicine in Sport. , v.12, p.85 - 90, 2009.
-
MARTINDALE, J. L.; HOLBROOK, N. J. Cellular response to oxidative stress: signaling for suicide and survival. Journal of Cellular Physiology, v. 192, p.1-15, 2002.
-
NORDBERG, J.; ARNÉR, E. S. J. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system. Free Radical in Biology and Medicine, v. 31, n. 11, 1287-1312, 2001.
-
RIETVELD, W. J. General introduction to chronobiology. Brazilian Journal of Medical and Biological Research, v. 29, n. 01, p. 63-70, 1996.
-
SCANDALIOS, J. G. Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses. Brazilian Journal of Medical and Biological Research, 38: 995-1014, 2005.
-
SCHNEIDER, C. D. E.; OLIVEIRA, A. R. Radicais livres de oxigênio e exercício: mecanismos de formação e adaptação ao treinamento físico. Revista Brasileira de Medicina do Esporte, v. 10, p. 87-90, 2004.
-
SCOCCIA, A. E. et al. simple method to assess the oxidative susceptibility of low density lipoproteins. BMC Clinical Pathology, v.1, p.1 - 5, 2001.
-
SIES, H. Oxidative stress: oxidants and antioxidants. Experimental Physiology, v. 82, p. 291-295, 1997.
-
SMITH, I. K. et al. Assay of glutathione reductase in crude tissue homogenates using 5,5’-dithiobis(2-nitrobenzoic acid). Analytical Biochemistry, v. 175, p. 408-413, 1988.
-
SUZUKI, K. et al. Capacity of circulating neutrophils to produce reactive oxygen species after exhaustive exercise. Journal of Applied Physiology, v. 81, n. 03, p. 1213-1222, 1996.
-
THOMPSON, J. L.; RILEY, D. A. Ultrastructure of muscle eccentric lesions. Medicine and Science in Sports and Exercise, v. 28, n. 05 (supplement), p. S113, 1996.
-
WISEMAN, H.; HALLIWELL, B. Damage to DNA by reactive oxygen and nitrogen species: role in inflammatory disease and progression to cancer. Biochemistry Journal, v. 313, p. 17-29, 1996.
-
YAGI, K. A. A simple fluorimetric assay for lipoperoxide in blood plasma. Biochemistry and Medicine, v. 15, p. 212-216, 1976.
Outros artigos em Portugués
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista Digital · Año 16 · N° 159 | Buenos Aires,
Agosto de 2011 |
|