Diferencias
generales entre las células musculares
También llamadas indistintamente “Fibras Musculares” debido a la
forma fusiforme que estas células poseen, su diferenciación histológica no es
nada nuevo. Hace más de medio siglo, varios histólogos alemanes efectuaron
biopsias para determinar las distintas posibilidades de rendimiento según la
estructura microscópica observada.
En el ser humano el número de fibras de un grupo muscular, está establecido
después de que el embrión tiene 4 a 5 meses (MacCallum, 1898; Gollnick y col.,
1981)
Con el crecimiento y desarrollo varia el espesor de la fibra muscular (Lockhart,
1973)
Por esta causa, ya entonces, se habló de dos clases de células musculares: las
“tónicas” por un lado y las “fásicas” por el otro
(Gunther, 1950).
En la década de los sesenta, las diferencias se establecieron por el aspecto de
las células bajo la información del microscopio, específicamente determinadas
por su color: rojas u oscuras, blancas o claras. Las rojas u oscuras eran lentas
o poco fatigables, mientras que las blancas eran rápidas, pero poco
resistentes.
En la misma década también se empezó a estudiar la actividad de las enzimas,
sus distintas funciones y procesos de adaptación.
Se pudo constatar un hecho muy importante: que entre otras causas, las
diferencias funcionales entre las células musculares respondían al
comportamiento de la enzima ATPasa de la cabeza de la miosina (Brooke y Engle,
1969).
Con el tiempo comenzaron a desarrollarse metodologías de investigación más
sofisticadas, dado que se aplicaron preparados químicos que alteraban el color
básico de la célula muscular.
Es por tal motivo, que se decidió denominarlas como “slow twitch fiber”
o STF (fibras de contracción lenta) y “fast twitch fiber” o
FTF (fibras de contracción rápida).
Para facilitar su denominación, también se las designó como fibras Tipo I a
las de contracción lenta y Tipo II a las veloces o contracción rápida
(Edstrom y Nystrom, 1969).
Otros investigadores decidieron diferenciarlas de acuerdo a su funcionabilidad,
tal es así, que a las fibras rápidas se las denominó como glucolíticas
anaeróbicas, mientras que a las lentas se las llamó oxidativas
(Peter, Barnard, Edgerton, Gillespie y Stempel, 1972).
Se pudo comprobar que si bien la división entre fibras Tipo I (STF) y Tipo II
(FTF) era correcta, fue necesario efectuar determinadas subdivisiones, teniendo
en cuenta la variedad de rendimiento deportivo por un lado y las reacciones ante
preparados químicos específicos por el otro. Esto se comprobó mediante la
preincubación de las células musculares en medios que tenían tres niveles de
pH diferentes: 4.35, 4.61 y 10.80.
La reacción de las células en estos tres distintos estados permitió modificar
la coloración de la ATPasa, lo que determinó que dentro del grupo I no hubo
diferenciación, pero en el grupo II aparecieron los subtipos IIa, IIb y IIc,
(Billeter, Eximan y Howald, 1981).
Más recientemente se halló un nuevo tipo de célula muscular, la cual se
denomina tipo IIX (García Manso, Navarro Valdivieso, Legido Arce, Vitoria
Órtiz, 2006).
Este tipo de célula muscular tiene las características fundamentales de las
II, es decir, contracción muy rápida, pero extremadamente fatigables. Aunque
parezca contradictorio, son más abundantes en humanos de vida sedentaria con
relación a los que se especializan en pruebas de velocidad. Cuanto más se
incrementa el volumen del entrenamiento, mayor será la pérdida de las
características de estas fibras IIX.
Actualmente se reconoce que el nivel cualitativo del rendimiento deportivo está
sustentado principalmente sobre la estructura del “mosaico” de células que
componen los distintos grupos musculares.
La composición muscular que estará determinada por la prevalencia de los
distintos de células, determinará la orientación del deportista, y esto tiene
tanta importancia como lo tiene la medición del VO2 Máx., el Volumen minuto o
Gasto Cardíaco, el tamaño o contractibilidad miocárdica, la cantidad de
hemoglobina, etc.
Por este motivo, cuando se trata del desarrollo de resistencia, los procesos de
adaptación se desencadenan primero a nivel de las células musculares y recién
después sobre el aparato cardiovascular y respiratorio (Howald, 1989).
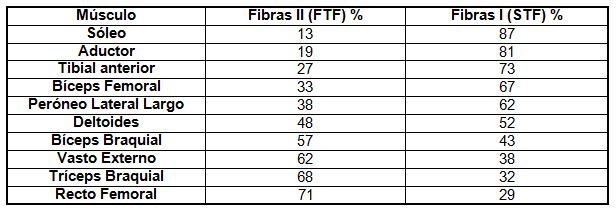
Según el grupo muscular, existirá predominio de uno de los tipos básicos de
fibra muscular por sobre el otro. Por ejemplo, el músculo sóleo posee
prevalentemente fibras del grupo I, relativamente poco fatigables, pero también
con escasa capacidad de hipertrofia. En general ocurre los mismos con los
músculos anti gravitacionales de la espalda (Saltin, Henriksson, Nygaard y
Andersen, 1977).
En cambio, los músculos extensores del codo tienen prevalencia de las fibras
II.
Un estudio realizado sobre biopsias musculares en sujetos varones cuyas edades
oscilaron entre 20 y 30 años de edad, determinó la siguiente distribución de
fibras en la musculatura corporal:
Tabla
1 (Lamb, D.R.; Physiology of Exercise, 1984)
Las fibras musculares del tipo II, las cuales son estimuladas desde las
motoneuronas alfa, -situadas en el asta anterior de la médula espinal-, poseen
una estructura nerviosa con un axón o cilindro eje más grueso, con alta
frecuencia de impulsos en la unidad de tiempo (bips) y por este motivo se
reclutan a mayor velocidad (35 mseg.) que las fibras lentas tipo I las cuales lo
hacen en 75 mseg. (Gollnick, Armstrong, Saubert, Pihel y Saltin, 1972).
Las fibras Tipo II permiten, por lo tanto, elevada velocidad de contracción, lo
cual favorece esta capacidad y por consecuencia el desarrollo de Hiperplasia de
las miofibrillas contráctiles con la consiguiente Hipertrofia muscular y por lo
tanto aumento de la fuerza muscular.
Otras investigaciones (Komi, 1983) determinaron una alta correlación
estadística entre la prevalencia de fibras musculares del tipo II con relación
a la saltabilidad. Ello es obvio, teniendo en cuenta la mayor concentración de
ATP y de CPK en este grupo de células. Con ello se posibilita una incrementada
velocidad de despegue del piso con relación a las personas con predominancia de
fibras Tipo I.
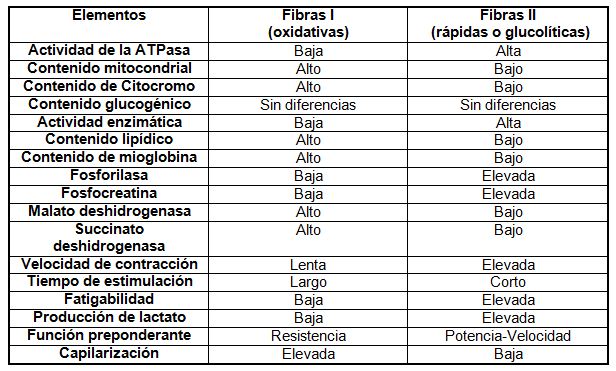
Teniendo en cuenta el tipo de célula muscular, si es de contracción lenta o
rápida se pueden constatar las siguientes características o magnitudes:
Tabla
2 (Hollmann/ Hettinger, Sportmedizin 1990)
Diferencias
metabólicas y estructurales entre las células musculares.
Lo que sí es seguro, es que el grupo I tiene mayor densidad mitocondrial que
las II; ello es obvio, desde el momento que son menos fatigables y con
predominancia de los procesos oxidativos aeróbicos que se realizan
exclusivamente en las mitocondrias.
Las fibras II tienen una correlación lineal con el grado de fatigabilidad
(r=0.86, p<0.01): esto determina entonces que el grado o punto de aparición
de la fatiga del músculo está en intima correlación con la superficie de las
fibras o células II (Thortensson y Karlsson, 1976). Cambia el panorama cuanto
mayor es la superficie de las fibras I dentro del paquete muscular. En este caso
disminuye la aparición de la fatiga, se incrementa la duración del trabajo,
aunque presenten menor velocidad de contracción y desarrollo de fuerza en
relación a las fibras II.
Uno de los hechos más importantes que se presentan para justificar dicha
diferencia funcional es la actividad del Magnesio (Mg++) como cofactor de la
ATPasa de la miosina. La actividad de esta enzima no es similar para ambos tipos
de fibras musculares (Thortensson, Sjodin, Tesch y Karlsson, 1977): las del
grupo II tienen mayor actividad, con una más rápida hidrólisis del ATP (es
decir más rápida liberación de la energía contenida en los enlaces del ATP)
en relación a las del grupo I (Barmard, 1970; Peter, 1972; Kugelberg, 1973;
Schantz, 1986).
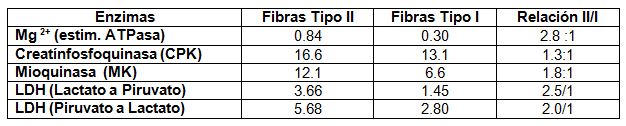
En realidad las enzimas citoplasmáticas muestran una mayor actividad en las
fibras tipo II. La relación del Magnesio es casi tres veces superior en las
fibras tipo II con respecto a las tipo I; aunque no hay mucha diferencia en la
actividad de la CPK (1.3/1).
Es indudable, que la mayor actividad de las fibras tipo II, responde a mayores
contenidos de determinados substratos, lo que se resume en la Tabla 2.
Tabla
3. Valores en moles x 10 gramos de proteínas (Según Thorstensson, Sjodin,
Tesch y Karlsson, 1977)
Diferencias
de índole molecular entre las diferentes tipos de fibras
Investigaciones más recientes han podido constatar diferencias fundamentales
desde el punto de vista molecular entre ambos tipos de células o fibras
musculares; inclusive dentro del mismo grupo la subdivisión surge no sólo como
producto de preincubaciones químicas a distintos niveles de pH, sino también
por la distinta estructura molecular.
Las diferencias en este último aspecto se comprueban específicamente a nivel
del sarcómero, particularmente en los filamentos de miosina o filamentos
gruesos. No se han comprobado diferencias entre las fibras tipo I y II con
relación a los filamentos de actina (Billeter, 1981).
Teniendo en cuenta los distintos niveles de rendimiento en el deporte, dicha
diferenciación surge, entre otros factores, debido a los distintos
encadenamientos de las cadenas peptídicas de la miosina.
Las mismas se dividen en cadenas pesadas y cadenas livianas. Las cadenas pesadas
son de tres tipos:
-
Cadena
Pesada Rápida A (HCA, Heavy Chain A)
-
Cadena
Pesada Rápida B (HCB, Heavy Chain B)
-
Cadena
Pesada Lenta (HCS, Heavy Chain Slow)
Por su parte, las cadenas livianas de la miosina se identifican mediante la
siguiente clasificación:
-
Cadena
Liviana Rápida 1 (LCF1, Light Chain Fast 1)
-
Cadena
Liviana Rápida 2 (LCF2, Light Chain Fast 2)
-
Cadena
Liviana Rápida 3 (LCF3, Light Chain Fast 3)
-
Cadena
Liviana Lenta 1 (LCS1, Light Chain Slow 1)
-
Cadena
Liviana Lenta 2 (LCS2, Light Chain Slow 2)
Existen diferencias en los pesos moleculares entre las cadenas pesadas y las
livianas; las primeras tienen un peso molecular de 200.000, mientras que las
cadenas livianas varían entre 14.600 y 23.900. Las cadenas livianas se
encuentran ubicadas en la cabeza de la miosina, lo cual es de gran importancia
debido a que, precisamente en ese lugar se encuentra ubicada la ATPasa,
responsable de determinar el deslizamiento de la miosina con respecto a la
actina.
Las fibras musculares tipo IIa y IIb tienen las mismas tres cadenas livianas
rápidas (LCF1, LCF2, LCF3); esto induce a pensar que la sutil diferencia entre
ambas puede estar en las dos cadenas pesadas, las cuales, obviamente son
rápidas. Concretamente, las diferencias se dan a través de distintas
secuencias de aminoácidos, las cuales se evidencian en diferentes niveles de la
ATPasa durante su coloración histoquímica.
Las diferencias estructurales entre las fibras tipo I con respecto a las tipo II
son muy evidentes, no sólo del punto de vista cualitativo sino también
cuantitativo. Las fibras de contracción rápida II no poseen cadenas pesadas
lentas, sólo rápidas, lo mismo ocurre en relación a las cadenas livianas. La
cadena pesada de la fibra tipo I, en cambio, es lenta; las cadenas livianas
poseen, no solamente cadenas livianas lentas, sino también rápidas.
El número de las mismas varía, y ello determinaría su distinta
funcionabilidad (Billeter, 1981).
Se han podido encontrar variadas combinaciones de cadenas livianas lentas y
rápidas; en algunos casos se encontraron solamente dos cadenas livianas lentas
y dos rápidas. Hay que destacar, nuevamente, que esta variada estructura
molecular determina distintos tipos de fibras tipo I (Schanz, 1986).
En las actuales divisiones de fibras musculares también se hace mención a las
IIc. ¿Cuáles son sus características? Las mismas no son únicamente de
contracción rápida, sino además son resistentes debido a que poseen elevada
densidad mitocondrial (Howald, 1989). Desde el punto de vista molecular se
encontró en estas fibras una amplia combinación de características propias de
las fibras IIa, IIb y I. En las fibras IIc la miosina posee dos cadenas pesadas,
una lenta y otra rápida: HCF + HCS. Además de ello, existen tres cadenas
livianas rápidas y dos cadenas livianas lentas. Estas características
estructurales hacen de las fibras IIc sean las más versátiles desde el punto
de vista funcional con relación a las restantes. Sin embargo, entre las
distintas biopsias efectuadas solo se han encontrado a las mismas en una
proporción del 2% con respecto a las restantes (Billeter, 1981) razón por la
cual son muy poco tenidas en cuenta a la hora de entrenar u orientar. Se dice
que las fibras IIc podrían constituir el paso intermedio entre las fibras tipo
I y II (en ambas direcciones y como producto de un proceso de entrenamiento).
Cambios
entre los distintos tipos de fibras o células musculares
Hay que reconocer en este aspecto que la fibra muscular posee un grado de
plasticidad superior a lo que en décadas pasadas se sostuvo (Nett, 1955). Es
indudable que para entonces se consideraron únicamente cambios funcionales
sumamente globales, los que se podían apreciar únicamente por un mejor
rendimiento deportivo. Para la comprobación de estos cambios, fue necesario
realizar extensos estudios longitudinales, los cuales duraron varios años y con
entrenamientos muy específicos.
Hoy en día aún con un entrenamiento sistemático de algunas semanas, ya se
pueden constatar íntimos cambios, tanto estructurales como también
metabólicos.
Estos cambios se producen desde el tipo de fibras II al I, pero no a la inversa
(Jolesz, Sréter, 1981), sin que estos cambios enzimáticos o moleculares
impliquen una transformación histoquímica del tipo de fibra I o II. Las
transformaciones se pueden resumir de la siguiente forma y teniendo en cuenta la
aplicación de estímulos lentos:
-
La
actividad enzimática oxidativa y la densidad capilar pueden incrementarse
con una semana de trabajo.
-
Con
dos ya se producen variaciones en la propiedad contráctil isométrica; en
la tercera un descenso de la actividad de la ATPasa.
-
Entre
la tercera y sexta semana existen modificaciones a nivel molecular con
respecto a la estructura de la miosina y la troponina (Salmons, Henriksson,
1982).
Esto en lo que se refiere a esfuerzos desarrollados en forma relativamente “lenta”,
a la manera de la metodología aeróbica, pero no corriendo, sino aplicando
estímulos eléctricos de baja frecuencia (10 bips/seg.) y durante un periodo
relativamente prologado.
¿Ocurre lo mismo en el camino inverso? ¿Pueden las fibras tipo I adoptar las
características del grupo II?
Los hechos y comprobaciones científicas están demostrando que no.
Aparentemente, en un primer momento, existe una transformación; las fibras tipo
I se hacen “más veloces”, pero no bien cesa el estímulo, estas fibras
retornan a sus características genéticas originales (Salmons, Henriksson,
1981). Esto lo comprendemos a partir del momento en que las actividades de la
vida diaria de relación constituyen, básicamente, estímulos de bajo umbral de
excitación, las cuales están en consonancia con las fibras de contracción
lenta:
Las
fibras I están diariamente en su verdadero medio ambiente.
Observaciones como estas nos inducen a pensar que los deportistas especialistas
en velocidad podrían mejorar sensiblemente su potencia y capacidad aeróbica
mediante entrenamientos sistemáticos efectuados a la manera de un fondista; por
el contrario, el camino inverso parece improbable.
Cambios
metabólicos causados por el entrenamiento
Las modificaciones que pueden tener algunos tipos de fibras son producto de
aquellos cambios que sufren como consecuencia de sistemáticos estímulos
específicos a los cuales se las someten. Es por este motivo que, estudios
histoquímicos y con microscopía electrónica han podido constatar interesantes
transformaciones en las fibras como producto del entrenamiento sistemático.
Además, es interesante notar que una misma clase de estímulo puede producir
diferentes resultados, según el grupo de fibra muscular que se trate; en otros
casos, en cambio, ambos tipos de fibras tienen cambios similares, pero con
estímulos de distintas características.
Por ejemplo el volumen mitocondrial se incrementa en gran magnitud como producto
de entrenamientos sistemáticos a la manera de los fondistas. Se encontró un
incremento del 70% del contenido proteico mitocondrial por gramo de músculo,
como también un incremento del 100% de la capacidad oxidativa en cobayos
entrenados con esfuerzos prolongados (Holloszy, 1971). El incremento del volumen
mitocondrial se da tanto en las fibras I como también en las II como
consecuencia de adaptaciones enzimáticas (generalmente por aumento en la
velocidad que desarrollan las enzimas; estos cambios se dan en mayor magnitud en
las fibras II con respecto a las I, lo que indicaría que el velocista puede
incrementar su resistencia.
Esfuerzos aeróbicos de baja intensidad modifican la actividad enzimática de
las fibras tipo I y el mismo resultado se comprueba en las fibras musculares
rápidas tipo II, pero en este último caso, mediante la combinación con
trabajos anaeróbicos (Henriksson, Reitmann, 1976).
Las enzimas que incrementan su actividad son las oxidativas tales como Succinato
deshidrogenasa (SDH), Succinato oxidasa (SO) y la Citocromo oxidasa (Holloszy,
1971; Howald, 1989).
Esto podría apoyar la hipótesis de que la resistencia y/o potencia aeróbica,
no solamente se pueden incrementar mediante prolongados esfuerzos continuos,
sino también mediante el entrenamiento fraccionado rápido
(aeróbico/anaeróbico) y también el intermitente. Usando esta metodología se
tienen muy especialmente en cuenta las fibras musculares II, de contracción
rápida y sin desmedro de la velocidad como en el caso anterior. Por otra parte,
los trabajos de fuerza muscular activan las enzimas citoplasmáticas tales como
la mioquinasa, CPK, ATPasa y PFK.
Las fibras musculares de contracción rápida son considerablemente más
susceptibles a la hipertrofia que las STF, con mayor síntesis proteica a nivel
de los ribosomas.
De acuerdo a ello cambia la relación FTF/STF en relación a su superficie y en
beneficio de las fibras rápidas (FTF). Esto se ha comprobado en levantadores de
pesas como también en lanzadores y saltadores (Ëdstrom y Ekblom, 1972; Prinze
y col. 1976).
En conclusión la fibra muscular posee un elevado grado de adaptación,
constituyéndose en un excelente receptor para adaptarse a métodos específicos
de entrenamiento. Sin embargo, también puede ocurrir lo contrario: estos mismos
métodos de entrenamiento pueden desadaptar la fibra muscular en razón de no
cumplir con los objetivos de la especialidad deportiva. De esta forma no
solamente se modificará su metabolismo, sino que también se alterará su
estructura molecular.
Esto nos lleva a concluir que:
La preponderancia metodológica del entrenamiento debería estar estructurada
prevalentemente sobre el mecanismo energético que caracteriza a la
especialidad deportiva. Cuánto más no alejemos de este principio tanto mayor
será la desadaptación celular, lo que afectará el rendimiento.
Referencias
-
Berenard,
R.J., Edgerton, V.R., Peter, J.B. Effect of exercise on skeletal muscle:
biochemical and histological properties. J. Appl Physiol; 28. 1970.
-
Billeter,
R., Heitzman, C.H., Howald, H. Analysis of myosin light and heavy chain
types in single human skeletal muscle fibers. Eur J Biochem; 116.
1981.
-
Brooke,
M.H., Engel, W.K. The histographic analysis of human muscles biopsies with
regard to fiber types I. Adult males and females. Neurology; 19.
1969.
-
Buchtal,
F. Schmalbruch, H. Motor unit of mammalian muscle. Physiol Rev; 60.
1980.
-
Ëdstrom,
L. Nystrom, B. Histochemical types and size of fibers in normal human
muscles. Acta Neurologica Scandinavica; 45. 1969.
-
Garnet,
A.F. y col.: Motor unit organization in human medial gastrocnekius. J.
Physiologie. 287: 1978.
-
Gollnick,
P., Armstrong, R., Saubert, C., Piehl, K., Saltin, B. Enzyme activity and
fiber composition in skeletal muscle of untrained and trained men. J Appl
Physiol; 33. 1972.
-
Gunter,
P.G. Uber das Vorkommen von tetanischen Fasern in der quergestreiften. Skelettmuskulatur
des Menschen. 1950.
-
Hollmann,
W; Hettinger, Th.: Sportmedizin, Arbeits- und Trainingsgrundlagen.
Schattauer Verlag. 1990.
-
Holloszy,
J.O., Oscay, L.B., Mole, P.A., Don, I.J. Biomechanical adaptation to
endurance exercise in skeletal muscle. Muscle metabolism during exercise.
Penum Press, New York- London. 1971.
-
Howald,
H. Veranderunden, der Meskelfasern durch Training. Leistunsport 2.
1989.
-
Jolesz,
F., Sreter, F.A. Development innervation and activity pattern induced
changes in skeletal muscle. Annual Rev Physiol; 43. 1981.
-
Komi,
P.V. The influence of Muscle Fiber Compositions on Mechanical Aspects of
Muscle Function. Collected Papers on Sports Biomechanics, Nedlands,
W.A. (1983).
-
Kugelberg,
E. Histochemical composition contraction speed and fatigability of rat
soleus motor unit. J Neurol Sci; 20. 1973.
-
Laich,
G. Modificaciones morfológicas y funcionales inducidas en fibras
musculares esqueléticas humanas mediante ejercicios isocinéticos. Tesis
doctoral. Madrid, 1985
-
Lamb,
D.R.; Physiology of Exercise. Macmillan Publishing Company. New York.
1984
-
Nett,
T. Der Lauf, Bartels & Wernitz. . 1960.
-
Peter,
J.B., Bernard, R.J., Edgerton, V.R., Gillespie, C.A., Stempel, K.E.
Metabolic profiles of three fibers type’s skeletal muscles in guinea pigs
and rabbits. Biochemestry; 11. 1972.
-
Prirnze,
F.P., Hikida, R.S., Hagerman, F.C. Muscle fiber types in power lifters,
distance runners and untrained subjects. Pflugers Archives, 363.
1976.
-
Salmons,
S. Henriksson, J. The adaptative response of skeletal muscle to increased
use. Muscle Nerve; 4. 1981.
-
Saltin,
B., Henriksson, J. Nygaard, E, Anderson, P. Fiber type and metabolic
potentials of skeletal muscles in sedentary man and endurance runners.
Annals of the New York Academy of Science; 301. 1977.
-
Schantz,
P.G. Influence of physical Training on phenotypic expression of slow and
fast isoform of myofibril proteins. Acta Physiol Scand; Vol 128,
Suppl 558. 1986.
-
Thortensson,
A., Karlsson, J. Fatigability and fiber composition of human skeletal
muscle. Acta Physiol Scand; 98. 1976.
-
Thortensson,
A., Sjodin, B., Tesch, P., Karlsson, J. Actomyosin ATPasa, CPK, and LDH in
human fast and slow twitch fibers. . Acta Physiol Scand; 99. 1977.
Otros artículos sobre Actividad
Física y Salud
 |
|
|
EFDeportes.com, Revista Digital · Año 16 · N° 157 | Buenos Aires,
Junio de 2011
© 1997-2011 Derechos reservados
|




