
|
|||
|---|---|---|---|
|
|
Efeito do exercício resistido sobre a composição corporal e suas relações com variáveis glicêmicas e de insulinização: estudo de caso com gêmeas Efecto del ejercicio resistido sobre la composición corporal y sus relaciones con variables glicéricas y de insulinización: estudio de caso con gemelas |
|
|
|
*Professor de Educação Física Especialista em Atividades Físicas para diabéticos Mestrando em Educação Física, UFSC Docente na Universidade Federal do Amazonas **Professora de Educação Física. Mestre em Ciências da Motricidade Docente na UNIEURO, Brasília ***Professor de Educação Física. Mestre em Ciências Médicas, UnB ****Professor de Educação Física. Doutor em Bioquímica Docente na Universidade Católica de Brasília, UCB *****Professora de Educação Física. Doutora em Ciências da Saúde Docente na Universidade de Brasília Coordenadora do programa de educação em diabetes Doce Desafio, UnB |
Marcelo Rocha Radicchi* Adriana Cristina Barriviera Prada** André Otávio Protzek*** Francisco José Andriotti Prada**** Jane Dullius***** (Brasil) |
|
|
|
Resumo O objetivo do presente estudo foi avaliar o efeito do exercício resistido na composição corporal de gêmeas (uma com diabetes mellitus tipo 1 e outra não). As participantes desse estudo de caso foram duas gêmeas do sexo feminino (21 anos de idade). O programa de treinamento consistiu de 11 semanas de exercícios resistidos realizados na sala de musculação do Centro Olímpico da Universidade de Brasília. As medidas antropométricas e de composição corporal foram coletados de ambas no início e final do programa e também medida a glicose sanguínea da gêmea com diabetes tipo 1 no pré e pós-sessão de exercício. A participante com diabetes tipo 1 demonstrou perda de massa muscular e aumento na massa gorda. Em contrapartida, sua irmã apresentou aumento na massa muscular e perda de massa gorda. Concluímos que a gêmea com diabetes tipo1 não obteve melhora na composição corporal pelo fato de apresentar um descontrole glicêmico durante o período estudado, demonstrando que a prática de exercício resistido sem um controle glicêmico adequado não foi capaz de melhorar a composição corporal de gêmea com diabetes tipo 1. Unitermos: Diabetes Mellitus Tipo 1. Treinamento resistido. Composição corporal. Insulina
Abstract The aim of this study was to evaluate the effect of resistance exercise on body composition in twins (one with type 1 diabetes and some not). The participants of this case study were two twin girls (21 years old). The training program consisted of 11 weeks of resistance exercises performed in the weight room of the Olympic Center at the University of Brasilia. Anthropometric measurements and body composition were collected from both, in the beginning and at the end of the program and also measurements in blood glucose in the twin with type 1 diabetes, pre-and post-exercise session. The participant with type 1 diabetes showed loss of muscle mass and increased in fat mass. However, his sister (non-diabetic) showed an increase in muscle mass and fat mass loss. We conclude that the twin with type 1 diabetes did not improve the body composition since she presented an unbalanced control of her glycemic values during the study period, demonstrating that the practice of resistance exercise without adequate glycemic control has not been able to improve the body composition of the twin with type 1 diabetes. Keywords: Diabetes Mellitus type 1. Resistance training. Body composition. Insulin
|
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 15 - Nº 145 - Junio de 2010 |
|
|
1 / 1
Introdução
O treinamento resistido vem ganhando aplicação terapêutica em doenças metabólicas, como a diabetes mellitus, por promover uma melhora nos níveis de força e volume musculares, além de aumentar a concentração de vários hormônios e agentes que contribuem para um melhor controle glicêmico1. Estudos sobre o exercício resistido (ER) vêm aumentando progressivamente devido às descobertas dos benefícios desta prática como intervenção não-farmacológica para diferentes populações2; indivíduos saudáveis3, idosos4 e cardiopatas5. Os exercícios resistidos demonstram melhorar a força e potência musculares, além de diminuir o risco de lesões6 e aumentar o volume muscular (hipertrofia)1. Com base nessas evidências, o ER atualmente é recomendado pelo American College of Sports Medicine3, American Association of Cardiovascular and Pulmonary Rehabilitation7, American Heart Association8, American Diabetes Association9 com o intuito de melhora ou manutenção da saúde e aptidão física. Entretanto, alguns autores10,11,12 citam a escassez de estudos que examinem a utilização de programas de exercícios resistidos no tratamento não-medicamentoso da diabetes mellitus (DM) e seus efeitos na função muscular e composição corporal, principalmente na DM tipo 1, onde há deficiência na produção de insulina.
São escassos os estudos, particularmente com DM tipo 1, que descrevam a composição corporal destes indivíduos13, pois comumente se limitam em avaliar o Índice de Massa Corporal (IMC), sendo poucos os que avaliam o percentual de gordura (%MG) e somatotipos nesta população.
A deficiência de insulina promove um balanço nitrogenado negativo14, que pode ser sanado pelo uso exógeno de insulina. Assim, a diabetes tipo 1 (DM1) é considerada uma potente doença catabólica. Para esses sujeitos, a perda de massa representa uma perda de proteína e essa foi reportada em estudos10, 15. Entretanto, alguns estudos indicam a manutenção da massa livre de gordura ou, até mesmo, pequenos aumentos comparados com sujeitos não diabéticos15. Uma pesquisa do Diabetes Control and Complications Trial (1988) comparou diferentes protocolos de insulinização e reportou aumento da massa corporal quando utilizado um protocolo mais intensivo – contudo, foi observado posteriormente que este aumento se deveu principalmente à gordura corporal16.
Os mecanismos de perda muscular estão acelerados em várias doenças catabólicas, dentre elas, a diabetes. A diminuição da massa muscular é caracterizada por uma redução involuntária no peso corporal (5 a 10%) devido à acelerada degradação e reduzida síntese protéicas. Para Castaneda10, esse processo catabólico se encontra acentuado em condições de acidose metabólica, em presença de hormônios glucocorticóides e na resistência à insulina e, independentemente da causa, a perda muscular excessiva afeta negativamente a progressão das doenças, levando à fraqueza, inapetência, piora na qualidade de vida, aumento na morbidade e mortalidade, além de aumento nos períodos de internação.
A privação de insulina ocasiona degradação protéica em todos os tecidos. No diabético tipo 1, onde há total perda de produção de insulina endógena pelas células β das ilhotas de Langerhans do pâncreas, o não tratamento insulinoterápico impede a síntese protéica do tecido muscular. A insulinoterapia adequada diminui a degradação protéica e reduz a perda total de proteína corporal10, 17 por meio de mecanismos de supressão da liberação dos aminoácidos aromáticos e de cadeia ramificada integrantes do músculo, inibindo também a oxidação destes18, 12.
A diminuição da massa muscular pode prejudicar o controle metabólico do DM1 de duas formas: 1) redução da capacidade do tecido muscular esquelético utilizar a glicose sanguínea; 2) redução da habilidade de estocar o glicogênio no tecido muscular, favorecendo assim, a manutenção de quadros hiperglicêmicos a longo prazo19.
O treinamento físico poderia reverter as alterações nas proteínas mitocondriais musculares provocadas pelos estados de deficiência de insulina20, como pode acontecer em DM1 mal-controlados. Assim, na DM1, o treinamento resistido pode proporcionar benefícios metabólico-funcionais tais como maior captação muscular de glicose sanguínea, com melhoras no perfil glicêmico no período durante e pós-treino, aumento das reservas de glicogênio muscular e hepático, possivelmente influindo positivamente na diminuição da gravidade de eventos glicêmicos severos21.
O presente estudo avaliou os efeitos de um programa de exercício resistido na composição corporal de gêmeas, habitando na mesma residência, onde uma delas é portadora de diabetes mellitus tipo 1 (DM1) e a outra não (NDM).
Métodos
Todo o planejamento e realização das atividades, tanto as avaliações físicas, como o treinamento e acompanhamento dos sujeitos foram coordenados e executados pelos pesquisadores utilizando as instalações e materiais da Faculdade de Educação Física (FEF) e do programa de educação em diabetes Doce Desafio da Universidade de Brasília (UnB).
Amostra
A amostra do estudo foi composta por duas irmãs gêmeas (21 anos), caucasianas, pareadas em condições de vida, sendo uma DM1 e outra NDM. Os indivíduos, seus responsáveis e médicos pessoais foram informados sobre os procedimentos e métodos a serem realizados durante a pesquisa. O protocolo da pesquisa foi aprovado pelo Comitê de Ética em Pesquisa com Seres Humanos (CEP/FS) da Faculdade de Ciências da Saúde da UnB sob o n° 002/2005 e ambas, uma vez convidadas a participar da pesquisa, leram e assinaram o Termo de Consentimento Livre e Esclarecido. O presente estudo, seu planejamento e execução não divergiram das normas internacionais de experimentação com seres humanos22.
Anamnése
Em todas as sessões, as alunas preencheram uma ficha contendo dados sobre: 1) alimentação nas 3 horas precedentes à sessão, a fim de, na DM1, avaliar a tendência da glicemia, incluindo a contagem de carboidratos da alimentação que pudesse influenciar nos valores de glicemia pré, durante e pós treino; 2) horas de descanso noturno, coletado com os sujeitos por auto-relato, sendo devidamente anotadas na ficha própria; 3) uma avaliação subjetiva de intensidade, em escala progressiva, respondida em relação à atividade daquele dia logo após o término da aula, com 5 opções: 1 (muito leve), 2 (leve), 3 (moderada), 4 (intensa) e 5 (muito intensa). Para o indivíduo DM1, em todas as sessões foram também registrados os valores de glicemia (G/dl) pré e pós-exercício e a dose de insulina exógena (U-100) aplicada nas últimas horas que, supostamente, segundo padrões de referência23, estaria atuando de forma efetiva (pico de ação) no momento ou próximo a este. Em todos os momentos do preenchimento das fichas o pesquisador esteve presente para auxiliar o preenchimento.
Ao preenchimento e interpretação dos dados contidos na ficha da aluna diabética era dada especial atenção aos valores glicêmicos e dados relacionados à insulinização, a fim de se evitar complicações agudas relacionadas à glicemia alta ou baixa durante ou após a atividade física11. Alguns cuidados como medições glicêmicas antes, após ou até mesmo durante a atividade (caso necessário para verificação de um estado de hipo ou hiperglicemia), observação do pico de ação da insulina, e ingestão de carboidratos complementares antes da atividade caso a glicemia estivesse abaixo dos 100 mg/dl24 foram tomados.
Teste de esforço
Para determinação do nível de aptidão física inicial de cada sujeito foi realizado um teste ergoespirométrico. Foi utilizado um cicloergômetro onde o sujeito pedalava a uma velocidade constante de 60 RPM (rotações por minuto), com uma carga inicial e 50Watts de potência e aumentada em 25 Watts de potência a cada um minuto, impossibilitando o equilíbrio das respostas cardiorrespiratórias. Para mensuração das variáveis ventilatórias foi utilizado um espirômetro modelo TEEM 100 (Estados Unidos da América). O Limiar Anaeróbio (LA) foi considerado o ponto em que houve incremento não linear da razão de troca respiratória, e o menor valor do equivalente ventilatório de oxigênio (VE/VO2). O LA foi expresso em batimentos cardíacos por minuto (bpm) e considerado 139 bpm (DM1) e 153 bpm (NDM), sendo utilizados no treinamento cardiopulmonar.
Antropometria e composição corporal
Os sujeitos foram informados da vestimenta adequada durante a avaliação (short, top e tênis) e instruídos a evitar exercícios intensos 24 horas antes dos testes. Os dados de massa foram obtidos através de uma balança, marca Filizola (Brasil), com precisão de 100 g, sendo a capacidade máxima de 200 Kg e mínima de 0,1 Kg e a estatura em centímetros (cm) foi aferida em um estadiômetro com escala de 2 mm. O Índice de Massa Corporal (IMC) foi calculado considerando-se os dados coletados de peso (Kg) e altura (m) segundo a fórmula: IMC = Peso (Kg) ÷ Altura2 (m).
Ao total foram realizadas 5 avaliações para verificar a composição corporal em momentos distintos: pré-treinamento (M1= momento 0), durante o treinamento (M2 = mês 1, M3= mês 2 e M4= mês 3) e após 3 meses de destreinamento (M5= mês 6).
Para a mensuração das dobras cutâneas, foi utilizado um adipômetro marca Lange Skinfold Caliper, fabricado por Beta Technology Incorporated (Cambridge, Maryland), com precisão de 1,0 mm. Também foi utilizada uma fita métrica metálica e flexível para localização do ponto médio, marca Sanny Medical (Brasil), com precisão de 1,0 mm. Um paquímetro marca Sanny Medical (Brasil) com precisão de 1 mm foi utilizado para aferir os diâmetros ósseos. Todas as medidas de dobras cutâneas foram realizadas três vezes de forma rotacional, a leitura foi feita de 1 a 2 segundos após a compressão máxima do compasso e realizadas sempre no hemicorpo direito dos sujeitos. Um único avaliador treinado realizou todas as avaliações utilizando um erro técnico de medida de no máximo ± 0,8 mm.
Sabe-se da ausência de equações preditivas para densidade corporal (Dc) e %MG específicas para indivíduos diabéticos, sendo, portanto, utilizada para cálculo de Dc a equação de Jackson e Pollock 7 dobras25. As seguintes pregas cutâneas foram aferidas: tricipital (TR), subescapular (SE), supra-ilíaca (SI), peitoral (PT) e coxa (CX) de acordo com os procedimentos descritos por Harrison et al 26, abdominal (AB), determinada paralelamente ao eixo longitudinal do corpo, aproximadamente 2 cm à direita da borda lateral da cicatriz umbilical, e axilar média (AM), medida obliquamente acompanhando o sentido dos arcos intercostais26.
Foi utilizado o somatório das dobras cutâneas para estimar a densidade corporal (Dc) através da equação preditiva (QUADRO 1) para mulheres25. Já o percentual de massa gorda (%MG) foi calculado pela fórmula: %MG = (4,95/DC) -4,5 x (100)27.
Quadro 1. Equação preditiva utilizada para cálculo da densidade corporal
|
Dc = 1,0970 - 0,00046971 (X) + 0,00000056 (X)2 - 0,00012828 (Id) |
|
Dc= densidade corporal; X = Σ das sete dobras cutâneas; Id= Idade (anos). |
Sabe-se que a medida das dobras cutâneas é amplamente difundida no Brasil devido à sua facilidade e relativa precisão em estimar a gordura corporal. Entretanto, existe uma escassez de estudos que avaliem a aplicabilidade de equações para a composição corporal na população brasileira28.
Para a determinação dos componentes somatotipológicos, endomorfia, mesomorfia e ectomorfia foi empregado o protocolo de Heath-Carter29,26.
As características de cada sujeito aferidas antes do início do programa de treinamento (M1) se encontram no QUADRO 2.
Quadro 2. Características dos sujeitos antes do início do treinamento (período M1) com destaque à diferenças significativas (p<0,05)
|
Variável |
Sujeito DM1 |
Sujeito NDM |
Variável |
Sujeito DM1 |
Sujeito NDM |
|
Altura (cm) |
160,5 |
161,0 |
Endomorfia |
3,477 |
4,407* |
|
Peso Corporal (kg) |
56,45 |
65,65* |
Mesomorfia |
3,459 |
3,088* |
|
IMC (kg/m2) |
21,91 |
25,33* |
Ectomorfia |
2,047 |
0,848* |
|
Somatório de dobras (mm) |
74,00 |
116,0* |
Percentual de gordura |
15,832 |
22,619* |
|
Peso muscular (kg) |
25,754 |
27,312* |
Percentual de músculo |
45,607 |
41,602* |
|
Peso ósseo (kg) |
9,913 |
9,702 |
Percent. massa corporal magra |
84,168 |
77,381* |
|
Peso de gordura (kg) |
8,937 |
14,849* |
Massa Corporal Magra (kg) |
47,513 |
50,801* |
* Diferenças significativas
Avaliações glicêmicas
O teste de glicohemoglobina (HbA1c) reflete o controle glicêmico no período dos últimos 60-90 dias e foi realizado antes do início do treinamento somente no sujeito DM1, tendo um valor de 8,7%. Os valores de referência situam-se entre 4-6%, sendo considerado bom controle quando se obtêm valores menores que 7%30.
Todos os procedimentos invasivos, tais como punção capilar para coleta de sangue para medida glicêmica em aparelho glicosímetro e aplicação de insulina pessoais, foram realizados pela própria aluna diabética, já treinada e habituada a fazê-lo, e sempre acompanhados pelos pesquisadores. Foi utilizado um glicosímetro pessoal da marca Advantage integrante do sistema Accu-chek da Roche Diagnostics e suas respectivas tiras reagentes.
Não houve interferência direta no tratamento insulínico seguido pela DM1 em acompanhamento por seu médico pessoal. Contudo, como ela era orientada a realizar ajustes conforme as medidas de glicemia, e esta passou a ser mensurada com maior freqüência e atenção, a aluna, que utilizava um esquema supostamente intensivo de insulinização, gradualmente aumentou suas doses de insulina exógena para fazer frente às constantes hiperglicemias. Sob acompanhamento dos pesquisadores, realizava ajustes com análogo de insulina de ação ultra-rápida asparte, produzido por Novo Nordisk, numa relação de 1 unidade de U-100 para cada 50 mg/dl de glicemia acima de 120 mg/dl ou para cada 15 g de consumo de carboidratos.
Protocolo de treino
Inicialmente os sujeitos foram classificados com baixa aptidão física31, portanto, não foi utilizado o teste de Repetições Máximas (RM) para evitar possíveis lesões devido à intensidade deste teste. Assim, foi aplicado o protocolo proposto por Chiesa32 que possibilita a identificação da força máxima sem a necessidade do teste de 1RM. O protocolo foi realizado pelo pesquisador, treinado, nos momentos M1, M2, M3, M4 e M5.
O programa de exercícios resistidos foi composto utilizando-se o método de treinamento da musculação33 com séries distintas para cada fase do treinamento:
-
M2 (1º mesociclo): treinamento da Resistência Muscular Localizada, utilizando cargas de aproximadamente 60% da força máxima calculada em M1, 2 sets de 25 repetições para cada exercício com descanso ativo (intercalando exercícios para membros inferiores com superiores ou músculos não trabalhados no exercício anterior), sendo totalizados 8 exercícios para grupos musculares distintos;
-
M3 (2º mesociclo): treinamento da hipertrofia, utilizando cargas de aproximadamente 85% da força máxima calculada em M2, 3 sets utilizando-se o método da pirâmide33. Foram realizados 2 sets de 10 repetições com uma carga de 80% e um set de 8 repetições com carga de 85% do máximo, utilizando-se o descanso passivo (aproximadamente 30 segundos) e totalizando os mesmos 8 exercícios para grupos musculares distintos;
-
M4 (3º mesociclo): treinamento da hipertrofia e da força dinâmica com o uso de cargas maiores (aproximadamente 90% a 95% da força máxima calculada em M3), 3 sets utilizando-se o método da pirâmide, sendo o primeiro com 10 repetições (aproximadamente 85% do máximo calculado), 1 set com 8 repetições (aproximadamente 90%) e 1 set com 6 repetições (visando o treinamento da força dinâmica com cargas de aproximadamente 95% da força máxima calculada), totalizando 8 exercícios para grupos musculares variados.
Nos mesociclos 1 e 2 foi empregado um treinamento cardiopulmonar34 realizado em esteira ou em cicloergômetro com duração de 20 minutos. Para controle da zona-alvo proposta por Dantas34 foi utilizado um freqüencímetro marca Polar (Modelo A3 – Finlândia).
Análise estatística
Utilizou-se o software estatístico SAS (versão 8.0) no tratamento dos dados coletados. Foi realizada uma análise descritiva para todas as variáveis coletadas de composição corporal em ambos os sujeitos, com o objetivo de validar os testes estatísticos aplicados posteriormente.
Para as Figuras apresentadas, consideraram-se os valores iniciais (M1) como o ponto zero para ambos os sujeitos, sendo avaliados individualmente. Os sujeitos apresentavam diferenças individuais nas variáveis de composição corporal observadas quando da coleta de dados no período M1 (ver QUADRO 2). Cada variação observada nas avaliações subseqüentes (M2, M3, M4 e M5) está percentualmente relacionada à situação inicial de cada indivíduo (M1). Em seguida, foram efetuadas correlações entre variáveis de composição corporal do indivíduo DM1, sua quantidade de insulina e variáveis glicêmicas coletadas durante o treinamento (períodos M2, M3 e M4), utilizando-se o coeficiente de Spearman.
Resultados
Quando comparada a evolução das medidas antropométricas dos sujeitos NDM e DM1, observou-se nas Figuras um comportamento diverso. O sujeito DM1 demonstrou maior tendência à perda de massa muscular (FIGURA 1) e aumentos no percentual e peso de massa gorda (FIGURA 2), diferentemente do sujeito NDM, que apresentou acréscimos na massa muscular e uma perda maior do componente de gordura corporal (ver FIGURAS 1 e 2). Os resultados encontrados na aluna NDM, que neste caso serviu como controle, indicam ganho de massa magra corporal e perda de massa de gordura, apresentando evolução positiva nas variáveis antropométricas resultante da participação no treinamento (oposto do observado com a aluna DM1).
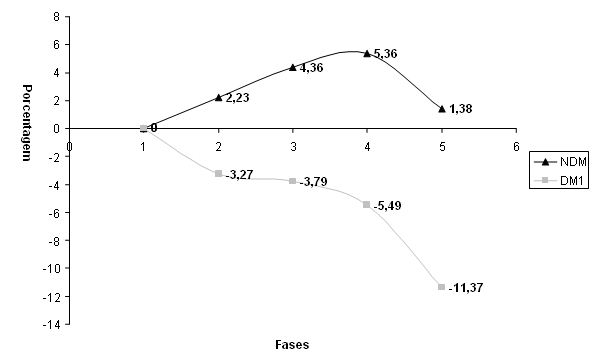
Figura 1. Variação Comparativa em Percentual para Peso Muscular nos sujeitos NDM e DM1
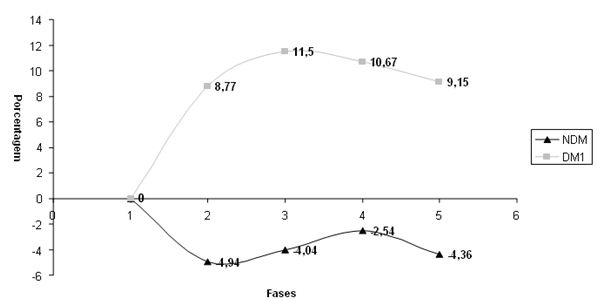
Figura 2. Variação Comparativa em Percentual para Peso de Gordura nos sujeitos NDM e DM1
Na FIGURA 3 temos os valores (em unidades) de insulina exógena que estivessem exercendo provável maior efeito durante a sessão23. Pela Figura, observa-se uma tendência de aumento na dose da insulina em efeito no exercício ao longo do estudo (linha de tendência ascendente), aumentando cerca de 25% nestas 11 semanas.
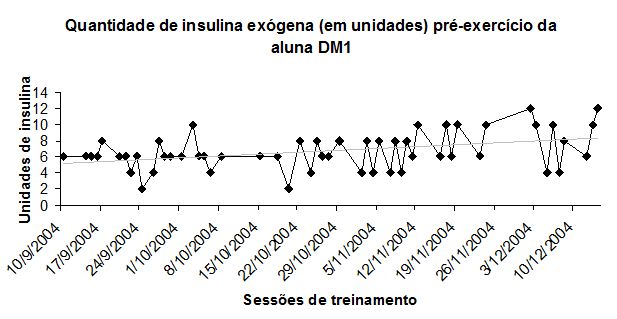
Figura 3. Quantidade de insulina (unidades) em efeito antes e durante cada sessão de treinamento para o sujeito DM1
Na FIGURA 4 temos as médias das glicemias aferidas da aluna DM1 medidas logo antes das sessões de exercícios no período de treinamento (M2, M3 e M4). Estas flutuaram entre 76 e 313 mg/dl, com médias nos períodos de M2 = 233±67 (mediana: 243), M3 = 168±69 (mediana 167) e M4 = 171±58 (mediana 180) mg/dl. Há uma grande variação nas glicemias (freqüentemente acima dos 100 mg/dl), principalmente até aproximadamente a 22ª sessão (período M2-M3), indicando a manutenção de um pobre controle glicêmico pré-sessão. O valor encontrado de HbA1c ao início do treinamento caracterizaria possivelmente um regime de tratamento inadequado (seja por desvios na aderência ao tratamento, ou pela inadequação deste ao estilo de vida da paciente, ou ambos11).
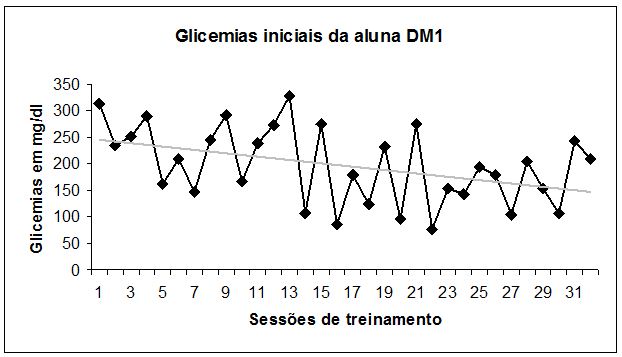
Figura 4. Média dos valores mensurados de glicemia (em mg/dl) antes da sessão de treinamento do sujeito DM1
Relacionadas à quantidade de insulina exógena aplicada foram encontradas as seguintes associações (coeficiente ordinal de Spearman): direta e forte com a variável peso muscular (Spearman = 0,97); direta e moderada para a variável peso de gordura (Spearman = 0,58). Todas as variáveis citadas tiveram p-valores maiores que 0,05 (p>0,05).
Correlacionadas com as variáveis da composição corporal coletadas durante o treinamento (M2, M3 e M4), destacam-se as associações indiretas encontradas entre glicemia e peso de gordura (Spearman = -0,77), percentual de gordura (Spearman = -0,78), ectomorfia (Spearman = -0,89) e endomorfia (Spearman = -0,16). O p-valor dessas associações foram todos não-significantes (p>0,05).
Discussão
Considerando que uma das gêmeas é portadora de diabetes e a outra não, buscou-se observar diferenças que poderiam se manifestar no comportamento de variáveis da composição corporal ao longo do treinamento feito de forma similar com ambas e inferir a influência do controle glicêmico e da insulinização sobre essas variações.
As grandes variações na composição corporal observadas para o sujeito DM1 nas FIGURAS 1 e 2 podem estar associadas a uma provável oscilação glicêmica acentuada, com hiperglicemias freqüentes. Estas eram corrigidas com doses extras de análogo de insulina exógena de efeito ultra-rápido. Sabe-se que ao mau controle glicêmico se associam estados catabólicos10 (perdas concomitantes de massa adiposa e magra). Assim, uma condição que proporcionasse picos hiperinsulinêmicos acompanhando refeições hipercalóricas (e de elevado conteúdo glicêmico) intercalados com períodos de baixa insulina circulante (que na diabetes do tipo 1 podem estar associados à manutenção da hiperglicemia) poderiam ter levado a um efeito prejudicial onde se observa ganho de massa gorda (hiperglicemia corrigida com grandes quantidades de insulina exógena) acompanhada por perda de massa muscular (períodos de baixa insulina circulante) na aluna DM1. Cabe ressaltar o já relatado risco aumentado de ganho de peso associado à insulinoterapia35,36.
A regulação da síntese protéica pela insulina depende da quantidade de insulina disponível e do estímulo para taxas alteradas de síntese protéica que, nesse caso, foi promovido pelo treinamento com exercícios resistidos. Hipoinsulinemia severa durante vários dias foi associada a reduções na taxa de síntese protéica em vários tecidos, incluindo no músculo esquelético33 – ou seja, a duração da hipoinsulinemia interfere no equilíbrio da síntese protéica. Observadas freqüentes hiperglicemias do sujeito DM1 (ver FIGURA 4), pode-se inferir ter sido este o caso.
Os resultados encontrados parecem concordar com um estudo onde ratos diabéticos hipoinsulinêmicos que executaram exercício extenuante obtiveram uma resposta anabólica (síntese protéica) deficiente quando comparados aos não diabéticos37. A hipoinsulinemia acentuada provocada nos ratos diabéticos provavelmente contribuiu para uma inabilidade de elevar as taxas de síntese protéica.
As relações diretas encontradas entre quantidade de insulina aplicada pré-treinamento e pesos muscular e de gordura (forte e moderada, respectivamente) tendem a indicar, na amostra DM1, uma associação do aumento do caráter anabólico nestes tecidos relacionada a uma maior quantidade de insulina pré-treino (originalmente visando proporcionar um melhor controle glicêmico, o que pode ser observado pela tendência descendente das glicemias na FIGURA 4).
As relações indiretas encontradas entre glicemia e peso de gordura, percentual de gordura, ectomorfia (todas três com coeficiente de relação forte) e endomorfia (fraco) parecem indicar na amostra a já citada associação de estados de mau controle metabólico (glicemias elevadas, com provável baixa insulina circulante e/ou esquema de insulinização inadequado) e perda de massa corporal, sob a forma de tecido adiposo e muscular.
Ao fim do período, observou-se uma gradual melhora no nível glicêmico pré-exercício (FIGURA 4), o que pode indicar uma provável colaboração do programa de treinamento para este aspecto de educação e controle da diabetes. Isto pode derivar do acompanhamento contínuo por um profissional de Educação Física qualificado na área, o que estimularia a autopercepção e autocuidado por parte da aluna em relação a vários aspectos, incluindo os valores glicêmicos38. Menor desvio-padrão relacionado à média das glicemias também foi observado à medida que evoluía o programa, indicando uma gradual amplitude de variação menor na glicemia pré-exercício por parte da aluna DM1, sendo este um aspecto muito favorável na educação em diabetes24.
A tendência observada de aumento nas doses de insulina a fim de corrigir as hiperglicemias pode, também, ter sido em parte motivada por um melhor acompanhamento e observação de suas variações glicêmicas, o que fez a aluna procurar seu médico que, junto com ela, promoveu um ajuste de dose, aumentando-a. Isto reforça o caráter de educação em diabetes no qual pode o programa ter colaborado11.
No entanto, deve-se ressaltar que todas as correlações realizadas entre as variáveis antropométricas e valores de glicemia pré-treino e de insulinização obtiveram um p-valor maior que 0,05. Ressalte-se que, como estudo de caso, as associações encontradas podem ser válidas somente para a amostra estudada.
Conclusão
Ressaltando o caráter exploratório e a complexidade do estudo, buscou-se a elucidação de alguns dados gerados como resultantes da aplicação de um mesmo protocolo de treinamento com exercícios resistidos em seres humanos pareados, relacionando-os com mensurações nas variáveis corporais e metabólicas, onde um dos dois sujeitos era uma diabética tipo 1 com um controle glicêmico instável. Conclui-se que o treinamento resistido por si só não foi capaz de promover melhoras nas variáveis da composição corporal na aluna diabética tipo 1 (DM1) condizentes com os benefícios observados em sua irmã gêmea não diabética (NDM), quando da participação concomitante de ambas no mesmo programa ajustado de treinamento resistido de 11 semanas de duração.
No entanto, talvez um efeito anabólico normalizado no tecido muscular pudesse ser verificado caso houvesse um melhor controle glicêmico por parte da aluna diabética (evitando-se períodos prolongados de hipoinsulinemia, melhor distribuição das refeições ao longo do dia e evitando-se picos hiperglicêmicos e/ou hipoinsulinêmicos), assim evitando períodos aumentados de catabolismo protéico, o que conseqüentemente favoreceria o equilíbrio nitrogenado positivo e a própria saúde da aluna.
Embora o estudo tenha observado uma amostra pequena, sem significado estatístico (mas metodologicamente ideal, como é o pareamento proporcionado por indivíduos gêmeos residindo no mesmo domicílio), os resultados encontrados para a amostra sugerem a importância de um bom controle glicêmico, além de esquema de insulinização adequado e condizente com a vida do paciente (alimentação, atividade física, horários, preferências etc.) para a obtenção dos resultados benéficos, tanto estéticos quanto morfofuncionais, da participação do sujeito diabético tipo 1 em um treinamento com exercícios resistidos.
Agradecimentos
Os autores agradecem à equipe de monitores que trabalharam no Programa Doce Desafio da Universidade de Brasília durante o período, facilitando os debates de estudos e a troca de experiências, à direção do Centro Olímpico da UnB por ceder o local para a realização das atividades, bem como à Comissão Organizadora do 15° Congresso da Sociedade Brasileira de Diabetes (Novembro 2005 – Salvador, BA), pela apresentação parcial do resumo do trabalho na forma de pôster. Também agradece à Ludmila Aguilar Lemos pela revisão. Um agradecimento especial às 2 irmãs participantes.
Contribuições dos autores
Marcelo Rocha Radicchi e Jane Dullius idealizaram o trabalho, participaram das coletas, e confeccionaram o documento final. Francisco José Andriotti Prada, Adriana Cristina Barriviera Prada e André Otávio Protzek foram responsáveis pela revisão do trabalho e contribuíram para a confecção do mesmo.
Referência
-
Hulver MW, Thyfault JP. Maximizing resistance training with supplementation. ACSM Fit Society Page. Fall, 2002.
-
Willoughby DS. Resistance Training in the Older Adult. ACSM Fit Society Page. Summer. 2003.
-
American College of Sports Medicine. Progression Models in resistance training for Adults. Med. Sci. Sports Exerc. 2002; 34:364-380.
-
Pollock ML, Graves JE, Swart DL, Lowenthal DT. Exercise training and prescription for the elderly. South Med J. 1994; 87(5):S88-95.
-
Feigenbaum MS, Pollock ML. Prescription of Resistance Training for Health and Disease. Med. Sci. Sports Exerc. 1999; 31: 38-45.
-
Fleck SJ, & Kraemer WJ. Designing Resistance training Programs. Champaign, IL: Human Kinetics. 2004.
-
American Association of Cardiovascular & Pulmonary Rehabilitation. Guidelines for Cardiac Rehabilitation and Secondary Prevention Programs. (3a Ed), Champaign, IL: Human Kinetics, 1999.
-
Fletcher GF, Balady G, Froelicher VF, Hartley LH, Haskel WL, et al. Exercise Standards: a statement for Health care Professionals from the American Heart Association. Circulation. 1995; 91:580-615.
-
Position Statemant American Diabetes Association. Physical activity/diabetes and exercise. Diabetes Care. 2004 ; 27: 558-562.
-
Castaneda C. Muscle wasting and protein metabolism. J. Anim. Sci. 2002; 80(E. Suppl. 2):E98-E105.
-
Dullius J, López RFA. Educação em diabetes através de programa orientado de atividades físicas para diabéticos: avaliação dos resultados com insulino-dependentes maiores de 16 anos. Tese de doutorado. Brasília: Universidade de Brasília. 2003.
-
Luciano E, Mello MAR. Atividade física e metabolismo de proteínas em músculo de ratos diabéticos experimentais. Rev. Paul. Educ. Fís. 1998; São Paulo, 12( 2): 202- 09.
-
Heyward, V. H., & Wagner, D. Applied Body Composition Assessment, Human Kinetics, Champaign. 2004.
-
Atchley D, Loeb R, Richards D, Benedict E, Driscoll M. On diabetic acidosis: a detailed study of electrolyte balances following the withdrawal and reestablishment of insulin therapy. J Clin Invest; 1933; 12: 297–326.
-
Rosenfalck AM, Almdal T. Body composition in adults with Type 1 diabetes at onset and during the first year of insulin therapy. Diabet Med. 2002; 19(5): 417-23.
-
Carlson M, Campbell P. Intensive insulin therapy and weight gain in IDDM. Diabetes; 1993; 42: 1700–1707.
-
Sreekumaran NK, Murdock-Dole D. Hormonal Regulation of Regional and Tissue Protein Turnover. Review Article for American Society of Animal Sciences. 2001; 1-16.
-
Genuth SM. Seção IX: O sistema endócrino. In: Berne R.; Levy M. Fisiologia. Guanabara Koogan. 1993. caps. 44-47.
-
Rosenfalck AM, Almdal T, Gotfredsen A, Viggers L. Increased lean body mass in patients with type 1 insulin-dependent diabetes mellitus: the relationship with metabolic control. Endocrinology and Metabolism. 1997; 4: 241-246.
-
Midaoui AE, Tancrede G, Nadeau A. Effect of physical training on mitochondrial function in skeletal muscle of normal and diabetic rats. Metabolism. 1996; 45(7): 810-6.
-
Dullius J; Equipe Doce Desafio. Diabetes Mellitus: saúde, educação e atividades físicas. Brasília: Edunb. 2007.
-
Declaração de Helsínque (1975, revista no ano de 2000).
-
Silverstein J, Klingensmith G, Copeland K, Plotnick L, Kaufman F, et al. Care of children and adolescents with type 1 diabetes: a statement of the American Diabetes Association. Diabetes Care. 2005; 28(1): 186-212.
-
Colberg SR. Exercise and the clinical management of type 1 diabetes. Clin Exerc Physiol, 2000; 2(2): 92-99.
-
Jackson AS, Pollock ML, Ward ANN. Generalized equations for predicting body density of women. Med Sci Sports Exerc. 1980; 12(3):175-82.
-
Harrison GG, Buskirk ER, CarterJL, Johnston FE, Lohman TG, et al. Skinfold thicknesses and measurement technique. In: Anthropometric Standardization Reference Manual, TG Lohman, AF Roche & R Martorell, eds. Human Kinetics Books, Champaign, 55-80. 1988.
-
Pollock ML, Wilmore JH. Exercício na Saúde e na Doença: Avaliação e prescrição para prevenção e reabilitação. Rio de Janeiro: Editora Medsi. 1993.
-
Rezende FAC, Rosado LEFPL, Priore SE, Franceschini SCC. Aplicabilidade de equações na avaliação da composição corporal da população brasileira. Rev. Nutr. 2006; 19(3): 357-367.
-
Fernandes Filho J. A Prática da Avaliação Física: Testes, Medidas e Avaliação Física em Escolares, Atletas e Academias de Ginástica. Rio de Janeiro: Shape, 2003.
-
Sociedade Brasileira de Diabetes. Atualização brasileira sobre diabetes. Rio de Janeiro: Diagraphic. 2006.
-
Kasari D, Heyward VH, Stolarczyk LM. The FIT (Frequency Intensity Time) index of Kasari. Universidade de Montana. Human Kinetics. 1976.
-
Chiesa LC. Teste de carga por repetições máximas. Revista Virtual EF Deportes. 2004; (2)3.
-
Fedele MJ, Hernandez JM, Lang CH, Vary TC, Kimball SR, et al. Severe diabetes prohibits elevations in muscle protein synthesis after acute resistance exercise in rats. J. Appl. Physiol. 2000; 88: 102–108.
-
Dantas EHM. Treinamento cardiopulmonar. In: Dantas EHM (4ª ed). A prática da preparação física. Rio de Janeiro: Shape. 1998.
-
Moraes CM, Portella RB, Pinheiro VS, Oliveira MMS, Fuks AG, et al. Prevalência de Sobrepeso e Obesidade em Pacientes com Diabetes Tipo 1. Arq Bras Endocrinol Metab. 2003; (47)6: 677-683.
-
Sociedade Brasileira de Diabetes. Consenso brasileiro sobre diabetes 2002: diagnóstico, classificação e tratamento do diabete melito do tipo 2. Rio de Janeiro: Diagraphic. 2003.
-
Farrel PA, Fedele MJ, Vary TC, Kimball SR, Jefferson LS. Effects of intensity of acute-resistance exercise on rates of protein synthesis in moderately diabetic rats. J Appl Physiol; 1998; 85: 2291-2297.
-
Dullius J. Educação em Diabetes tipo 1 através do PROAFIDI (Programa orientado de atividades físicas para diabéticos). Diabetes Clínica 2004; 03: 195-202.
Outros artigos em Portugués
 |

Búsqueda personalizada
|
|---|---|
|
revista
digital · Año 15 · N° 145 | Buenos Aires,
Junio de 2010 |
|