
|
|||
|---|---|---|---|
|
|
Análise histoquímica do músculo gastrocnemius submetido a treinamento de força e administração de GHAnálisis histoquímico del músculo gastrocnemio sometido a entrenamiento de fuerza y administración de GH |
|
|
|
*Laboratório de Microscopia Eletrônica, Instituto de Biociências Depto. de Biologia, Unesp - Rio Claro, São Paulo **Laboratório de Morfologia, Instituto de Biociências Depto. de Educação Física, Unesp – Rio Claro, São Paulo ***Laboratório de Mecanofisiologia, Faculdade Anhanguera de Bauru, Bauru, São Paulo. ****Laboratório Experimental em Animal, UNAERP – Ribeirão Preto, São Paulo |
Runer Augusto Marson* *** Flávio Henrique Caetano* Arthur Rizzi Soares** **** Francisco Pereira Santi** runer.marson@unianhanguera.edu.br (Brasil) |
|
|
|
Resumo Para este estudo foram utilizados 06 ratos Wistar, machos, com 90 dias. Os animais foram divididos randomicamente em 02 grupos: treinados sem administração do GH (RTSH) e treinados com administração do GH (RTCH). Os animais executaram 3 séries de 8 repetições. A dosagem administrada foi de 0,2UI/Kg três vezes na semana em dias alternados. Os animais foram sacrificados e a secção transversa do músculo gastrocnêmico removida e preparada segundo técnicas histoquímica para análises em microscópio óptico. As análises não demonstraram alterações morfológicas na estrutura do músculo gastrocnemius (Hematoxilina eosina). Na secção transversa dos RTSH e RTCH pode ser observado o acúmulo de colágeno nos espaços entre as fibras musculares, maior nos RTCH (Picrosirus red e Mallory). Assim podemos concluir que o treinamento de força não interfere na morfologia das fibras do músculo gastrocnemius mas quando esse é associado à administração de GH faz com que ocorre o acúmulo de colágeno entre os feixes de fibras musculares. Unitermos: Histoquímica. Hormônio de crescimento. Treinamento de força
Abstract For this study were used 06 rats (Wistar ±90 days). The animals were divided in 02 groups: rats trained without administration of GH (RTSH) and rats trained with administration of GH (RTCH). The animals performed the strength training during 08 weeks (3 days/weeks). The subcutaneous administration of the GH (0,2UI/mass) was for all period of strength training. After the animals was sacrificed and the crossection of the gastrocnemius muscle removed and prepared for histochemistry analysis. The results not demonstrated morphological alterations of gastrocnemius muscle (Hematoxilin Eosin). The cross section RTSH and RTCH were identified accumulation of tissue conjunctive (collagen), perceivable in the RTCH (Picrosirus Red and Mallory). The strength training no interfered in gastrocnemius muscle morphology, but associated with GH promoved the increase of protein synthesis and accumulation of collagen among gastrocnemius myofibrils. Keywords: Histochemistry. Growth hormone. Strength training |
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 14 - Nº 140 - Enero de 2010 |
|
|
1 / 1
Introdução
O hormônio do crescimento é um polipeptídio produzido e secretado pela glândula hipófise anterior. Durante a fase de crescimento, sob a ação deste hormônio, quase todas as células nos tecidos aumentam em volume e em número, propiciando o crescimento dos tecidos, dos órgãos e conseqüentemente, o crescimento corporal (POMBO, et al., 2001).
Alguns de seus principais, e conhecidos, efeitos nos tecidos são o aumento na síntese protéica celular, diminuição da utilização de glicose pelas células e o aumento da utilização de gordura pelas células para produção de energia.
Deste modo pode-se afirmar que, com o uso do hormônio do crescimento, pode-se, também, conseguir aumentar a massa muscular e conseqüentemente a força por ela gerada. Entretanto, para que isso ocorra tem-se que administrar doses suprafisiológicas. Essas características estão fazendo com que haja o aumentar do número de pesquisas relatando o uso abusivo, deste hormônio, por atletas para melhorar a performance. (Clarkson, 1991).
Estas observações fizeram com que pessoas saudáveis e atletas utilizassem do GH para promover um aumento da massa muscular e força. A melhora da força muscular obtida pôr um treinamento de resistência em homens saudáveis não aumentou com a administração do GH. Um aumento da massa magra foi observado em indivíduos que treinaram utilizando o GH onde obviamente não foi devido ao acréscimo das proteínas contrácteis, mas propriamente pela retenção de fluídos ou pôr acúmulo de tecido conjuntivo (Frisch, 1999).
Ainda que saibamos destas características promovidas pelo hormônio do crescimento temos que, cada vez mais, procurar subsídios teóricos e práticos para que a ação de doses suprafisiológicas, deste hormônio no organismo. Assim o presente estudo teve como objetivo identificar as possíveis alterações promovidas pela administração do GH no músculo gastrocnêmio de ratos submetidos a treinamento de força.
Material e métodos
O presente estudo utilizou-se de seis ratos machos Wistar, machos, com aproximadamente 90 dias de idade na fase inicial do experimento. Os ratos foram mantidos no Biotério do Laboratório Experimental em Animal da Universidade de Ribeirão Preto (UNAERP), em gaiolas coletivas, alimentados com ração balanceada e água “ad libitum”. Durante todo período do estudo, o biotério teve controle automático de luz e temperatura controlada de 23ºC. Os animais foram distribuídos nos seguintes grupos: Rato Treinado sem Hormônio (RTSH) e Rato Treinado com Hormônio (RTCH).
Os animais dos grupos RTSH e RTCH realizaram um trabalho de adaptação ao meio liquido por um período de 01 semana. Os animais foram submetidos a um teste de carga máxima (CM), para quantificar a maior sobrecarga possível conforme Marson et al (2009).
O protocolo de treinamento foi contemplado com a fase de adaptação ao treinamento, onde o treinamento constou da execução de 3 séries de 8 saltos com intervalo entre as séries de 90 segundos. A carga utilizada para a execução dos saltos será o equivalente a 45% (± 5%) da carga máxima. Este será realizado 3 vezes por semana durante 2 semanas. A fase principal do treinamento visando o ganho de massa muscular (hipertrofia) será administrado logo após o término da fase de adaptação com a execução de 3 séries de 8 repetições durante 8 semanas 3 vezes por semana, variando somente os percentuais de carga em relação a carga máxima (70%, 75%, 80%, 85% e 90%) (MARSON et. al, 2009).
O grupo RTCH teve administrado o hormônio de crescimento (GH) durante toda fase de treinamento. A dosagem será de 0,2UI/kg e sua administração via subcutânea, no dorso do animal, 3 vezes por semana em dias alternados e o peso corporal dos animais foram aferidos nos dias de administração do GH, para correção da dosagem.
Após este período de treinamento os animais foram sacrificados e a seção transversa do músculo gastrocnemius foi removida. O material foi mantido em paraformaldeido tamponado durante 24 horas para as análises histoquímicas de Hematoxilina-Eosina, Picrosirus Red e Tricromio de Mallory. Antes das analises o mesmo foi incluído em resina Leica e cortados com 7µm, coletados em lâminas de vidro. As lâminas contendo material tratado histoquimicamente foram analisadas e fotografadas ao fotomicroscópio Zeiss.
Resultados
O GH é um hormonio anabólico capaz de aumentar a massa muscular (Salomon et al., 199). A figura 1 (A e B) e 2 (C e D) demonstram uma analise morfológica através da técnica HE onde é observada a estrutura que compõem a musculatura esquelética do músculo gastrocnemius, através de sua secção transversa tanto em corte longitudinal quanto transversal.
Em humanos, sabe-se que a administração promove aumento da massa corporal total e síntese protéica (Russell-Jones, Umpleby 1996; Marcus et al., 1990; Butterfield et al., 1997) e equivocadamente aumenta a massa magra e diminui a massa gorda (Crist et al., 1988; Richelsen et al., 1994; Holloway et al.,1994; Lange et al., 2000; Rudman et al., 1990; Jørgensen et al., 1989; Yarasheski et al., 1995).
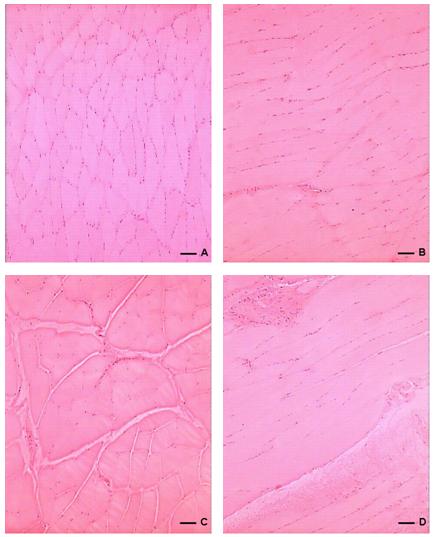
Figura 1. Hematoxilina-Eosina. A: Corte transversal do músculo gastrocnemius de RSSH. B: Corte longitudinal do músculo gastrocnemius de RSCH. As setas, tanto em A quanto e B, identificam o núcleo (seta preta), o endomísio (ponta da seta preta), o perimísio (ponta da seta branca) e a miofibrila (seta branca). C: Corte transversal do músculo gastrocnemius de RTSH. B: Corte longitudinal do músculo gastrocnemius de RTCH. As setas, tanto em C quanto e D, identificam o núcleo (seta preta), o endomísio (ponta da seta preta), o perimísio (ponta da seta branca) e a miofibrila (seta branca). (Escala = 78mm).
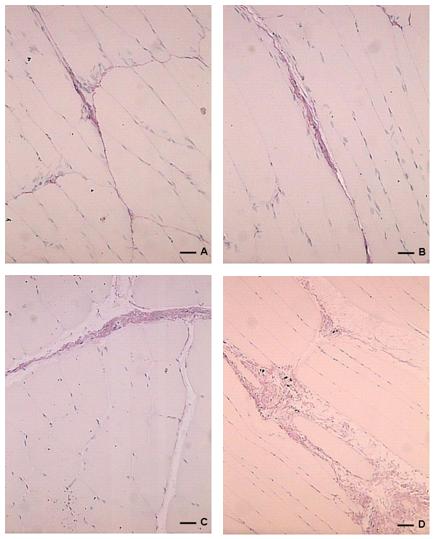
Figura 2. Picrosirus Red. A: Corte longitudinal do músculo gastrocnemius de RSSH. B: Corte longitudinal do músculo gastrocnemius de RSCH. As setas, tanto em A quanto e B, identificam o colágeno (seta peta). C: Corte transversal do músculo gastrocnemius de RTSH. B: Corte longitudinal do músculo gastrocnemius de RTCH. As setas, tanto em C quanto e D, identificam o colágeno (seta preta). (Escala = 78mm).
As análises histoquímicas não demonstraram alterações morfológicas na estrutura esquelética do músculo gastrocnemius como o núcleo da miofibrila, o perimísio e o endomísio. A técnica de HE não mostrou diferenças no músculo nos dois tipos de secções e tratamentos.
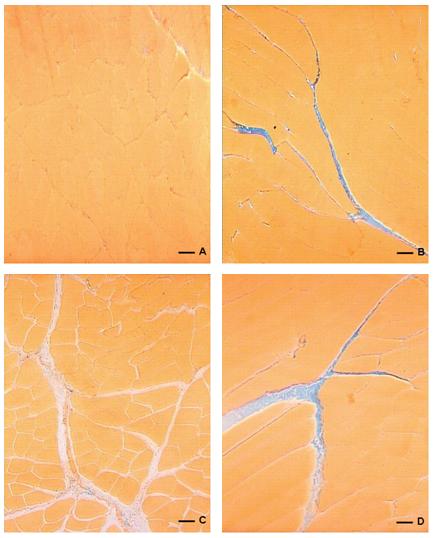
Figura 3. Tricrômio de Mallory. A: Corte transversal do músculo gastrocnemius de RSSH. B: Corte longitudinal do músculo gastrocnemius de RSCH. As setas, tanto em A quanto e B, identificam o espaço entre as miofibrilas onde pode ser observado o acúmulo de colágeno no RSCH (seta preta). C: Corte transversal do músculo gastrocnemius de RTSH. D: Corte longitudinal do músculo gastrocnemius de RTCH. As setas, tanto em C quanto e D, identificam o acúmulo de colágeno (seta preta). (Escala = 78mm).
Entretanto, o GH estimula indiretamente seu crescimento fazendo com que várias pequenas proteínas, denominadas coletivamente somatomedina, sejam formadas no fígado e talvez nos músculos e nos rins, que pôr sua vez age diretamente sobre a cartilagem e o osso para promover seu crescimento. A somatomedina é necessária para a deposição do sulfato de condotina e de colágeno, ambos os quais são necessários para o crescimento da cartilagem e do osso (Guyton, 1981).
Lange et al. (2002) relataram que somente a administração do GH não promove um aumento da secção transversa do músculo quadríceps ou induz a hipertrofia da fibra muscular demonstrando que a somente a administração de GH tem pouco efeito sobre a hipertrofia de músculo esquelético e força. Na figura 1 (A e B) demonstram uma analise morfológica através da técnica HE onde é observada a estrutura que compõem a musculatura esquelética do músculo gastrocnemius como o núcleo encontrado na periferia da miofibrila, o perimísio e o endomísio, através de sua secção transversa tanto em corte longitudinal quanto transversal não demonstrando alterações morfológicas do músculo sobre feito da administração do GH (Figura 1B).
Na secção transversa dos RTSH e RTCH, submetido à reação ao Direct Red 80 (Picrosirus red) (Figura 2-A 2-B), podem ser observados os acúmulos de colágeno nos espaços entre as fibras musculares (Marson et al., 2009). Com técnica do Tricrômio de Mallory (Figura 3-A e 3-B) foram observados grandes acúmulos de substâncias basófilas (azul), incluindo o colágeno, entre as miofibrilas. Estas características histoquímicas foram mais notórias no grupo RTCH.
Na figura 2 e 3 são demonstrados o acúmulo de colágeno na fibra muscular em maior abundância no RTCH (Figura 2-B e 3-B). O GH é um polipeptídio que tem papel importante na regulação da cicatrização, acelerando a formação local de tecido de granulação e o deposito de colágeno (Marson et al., 2009; Rasmussen et al., 1995; Steenfos, 1994; Steenfos; Jansson, 1992).
Green et al. (1985) afirmaram que o hormônio de crescimento estimula a formação de tecido por 2 mecanismos: um direto que leva a diferenciação de células precursoras e um mecanismo indireto, mediado pelo aumento do IGF-I, que estimula a proliferação celular por mecanismos autócrinos e parácrinos.
Segundo estes autores o GH é capaz de influenciar o metabolismo dos fibroblastos levando o aumento da síntese da matriz, incluindo os colágenos tipo I e III. Este acúmulo pode ser observado nas figuras 2, a secção foi corada pela técnica de Picrosirus onde pode se observar acumulo maior de colágeno nos espaços entre as fibras musculares, principalmente no RTCH (Figura 2-B) e nas figuras 3 foram coradas pela técnica do Tricrômio de Mallory onde também pode se observar um grande acúmulo de colágeno entre as miofibrilas, principalmente no grupo RTCH (Marson et al., 2009).
Portanto, o treinamento de força não interfere na morfologia das fibras do músculo gastrocnemius, mas quando esse é associado à administração de GH faz com que ocorra o acúmulo de colágeno entre os feixes de fibras musculares.
Referências bibliográficas
-
Butterfield GE, Thompson J, Rennie MJ, Marcus R, Hintz RL, Hoffman AR Effect of rhGH and rhIGF-I treatment on protein utilization in elderly women. Am J Physiol 272:E94–E99, 1997.
-
Clarkson PM. Nutritional ergogenic aids: chromium, exercise, and muscle mass. Int J Sport Nutr UNITED STATES; 1(3):289-93, 1991.
-
Crist DM, Peake GT, Egan PA, Waters DL Body composition response to exogenous GH during training in highly conditioned adults. J Appl Physiol 65:579–584, 1988.
-
Frisch H. Growth hormone and body composition in athletes. J Endocrinol Invest ITALY; 22(5 Suppl):106-9, 1999.
-
Green, H.; Morikawa, M.; Nixon, T. A dual effector theory of growth-hormone action.
Guyton, AC. Tratado de fisiologia médica. Tradução Alcyr Kraemer et al., revisão da tradução Charlies Alfred Esbérard.
Holloway L, Butterfield G, Hintz RL, Gesundheit N, Marcus R Effects of recombinant human growth hormone on metabolic indices, body composition, and bone turnover in healthy elderly women. J Clin Endocrinol Metab 79:470–479, 1994.
Jørgensen JO, Pedersen SA, Thuesen L, Jørgensen J, Ingemann-Hansen T, Skakkebaek NE, Christiansen JS Beneficial effects of growth hormone treatment in GH-deficient adults. Lancet 1:1221–1225, 1989.
Lange KHW, Isaksson F, Juul A, Rasmussen MH, Bu¨low J, Kjær M Growth hormone enhances effects of endurance training on oxidative muscle metabolism in elderly women. Am J Physiol Endocrinol Metab 279:E989–E996, 2000.
Lange, K.H.W.; Andersen, J.L.; Beyer, N.; Isaksson, F.; Larsson, B.; Rasmussen, M.H.; Juul, A.; Bülow, J.; Kjaer, M. GH administration changes myosin heavy Caín isoforms in skeletal muscle but does not augment muscle strength or hypertrophy, either alone or combined with resístanse exercise training in healthy elderly men. The Jurnal of Clinical Endocrinology & Metabolism. Vol., 87, p., 513-523, 2002.
Linderman JK, Gosselink KL, Booth FW, Mukku VR, Grindeland RE Resistance exercise and growth hormone as countermeasures for skeletal muscle atrophy in hindlimb-suspended rats. Am J Physiol 267:R365–R371, 1994.
Marcus R, Butterfield G, Holloway L, Gilliland L, Baylink DJ, Hintz RL, Sherman BM Effects of short term administration of recombinant human growth hormone to elderly people. J Clin Endocrinol Metab 70:519–527, 1990.
Marson, R.A.; Caetano, F.H,; Soares, A.R.; Santi, F.P. O efeito do Treinamento de força e administração do hormônio de crescimento sobre o músculo gastrocnemius. Lecturas: Educacion Fisica y Deportes, Revista Digital. Buenos Aires, 14(136), 2009. http://www.efdeportes.com/efd136/hormonio-de-crescimento-sobre-o-musculo-gastrocnemius.htm
Pombo, M. et al. Hormonal control of growth hormone secretion. Hormonal Research, vol. 55, p. 11-16, 2001.
Rasmussen, L.H.; Ga
Richelsen B, Pedersen SB, Børglum JD, Møller-Pedersen T, Jørgensen J, Jørgensen JO Growth hormone treatment of obese women for 5 wk: effect on body composition and adipose tissue LPL activity. Am J Physiol 266:E211– E216, 1994.
Rudman D, Feller AG, Nagraj HS, Gergans GA, Lalitha PY, Goldberg AF, Schlenker RA, Cohn L, Rudman IW, Mattson DE Effects of human growth hormone in men over 60 years old. N Engl J Med 323:1–6, 1990.
Russell-Jones DL, UmplebyM Protein anabolic action of insulin, growth hormone and insulin-like growth factor I. Eur J Endocrinol 135:631–642, 1996.
Salomon F, Cuneo R, Sönksen PH Growth hormone and protein metabolism. Horm Res 36(Suppl 1):41–43, 1991.
Steenfos H.H. Growth factors and wound healing. Scand Journal plast Reconstr Surgery Hand Surgery. Vol., 28, p., 95-105, 1994.
Steenfos, H.H.; Jansson, J.O. Grwoth hormonestimulates granulation tissue formation and insulin-l;ike growth factor I gene expression in wound chambers in the rat. Journal Endocrinology, Vol., 132, p., 293-298, 1992.
Yarasheski KE; Zachwieja JJ; Campbell JA; Bier DM.
Outros artigos em Portugués
 |
|
|---|---|
|
revista
digital · Año 14 · N° 140 | Buenos Aires,
Enero de 2010 |
|