
|
|||
|---|---|---|---|
|
|
Eritropoetina: breve revisão, doping e estatística Eritropoyetina: breve revisión, doping y estadística |
|
|
|
Alunas da Faculdade de Biomedicina do Centro Universitário Feevale, Rio Grande do Sul (Brasil) |
Larissa Machado Lacerda Carla Madeira Marques Caroline Zuanazzi |
|
|
|
Resumo A eritropoetina é um hormônio com atividade muito significativa para a função orgânica eritróide, responsável pelo estímulo da produção de eritrócitos. Devido a isto, desde 1988, tem sua forma sintética (EPO Humana Recombinante – rHuEPO) disponível no mercado farmacêutico. Inicialmente a rHuEPO foi utilizada na clínica médica como opção de tratamento para desordens como anemias conseqüentes à insuficiência renal ou alternativa para pacientes que necessitam de transfusões sanguíneas com freqüência. Entretanto, esta forma sintética deste hormônio, também vem sendo usada para fins ilegais: doping no âmbito esportivo em atletas competitivos de elite. Eritropoetina traz benefícios em relação à oxigenação, assim como é responsável pelo aumento na potencialidade farmacocinética da hemoglobina, levando a uma competência aeróbica mais eficaz, o que gera um aumento da capacidade desportiva em atletas de ‘endurance’. Contudo, concomitante aos benefícios, alguns atletas podem vir a sofrer por efeitos adversos ocasionados pelo uso indiscriminado da eritropoetina sintética, o que vem se tornando um grave problema no âmbito esportivo. Aliado a isto, tem-se uma detecção laboratorial que ainda apresenta deficiências e necessita de melhoramentos, já que as diversas isoformas de EPO sintética possuem características semelhantes. Unitermos: Eritropoetina. Eritropoetina recombinante. Doping
Abstract Erythropoietin (EPO) is a hormone with a very significant activity for the erythroid organic function, responsible for stimulating the production of erythrocytes. Because of this, since 1988, it has its synthetic form (recombinant human EPO – rHuEPO) available in the pharmaceutical market. Initially the EPO has been used in medicine as an option for treating disorders such as anemia consequent to renal failure or alternative for patients who require frequent blood transfusions. However, the synthetic form of this hormone is also being used for illegal purposes: doping in sports as part of elite competitive athletes. Erythropoietin provides benefits on oxygenation, as well as it is responsible for the increase in pharmacokinetics potentiality of hemoglobin, leading to a more effective aerobic power, which generates an increase in sports capacity of endurance athletes. However, concomitant to the benefits, some athletes may experience the adverse effects caused by the indiscriminate use of synthetic erythropoietin, which has become a serious problem in the sports scope. Allied to this, there is a laboratory detection that still has shortcomings and needs improvement, since the different isoforms of synthetic EPO have similar characteristics. Keywords: Erythropoietin. Recombinant Human Erythropoietin. Doping |
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 14 - Nº 134 - Julio de 2009 |
|
|
1 / 1
Introdução
No esporte, a busca pela perfeição no desempenho físico é algo almejado em todas as categorias. Principalmente nas modalidades de “endurance”, que exigem um condicionamento potente, a fisiologia e bioquimismo do atleta são processos fundamentais1. Com o objetivo de um aumento artificial de seu desempenho, através de uma alta oxigenação tecidual, ocasionada por aumento do número total de eritrócitos, muitos esportistas se valem de práticas ilícitas, envolvendo um importante hormônio: a eritropoetina (EPO)1, 2.
O uso da EPO para doping surgiu na década de 70, através do condicionamento dos atletas a câmaras hipobáricas (o que induz aumento da síntese de eritrócitos) e transfusões sanguíneas1, 3. Estas práticas só deixaram de existir em 1988, quando laboratórios desenvolveram uma forma sintética de eritropoetina4. A partir disto, as atenções de organizações esportivas de todo o mundo se voltaram para este tipo de doping, e técnicas de detecção para esta droga foram, e continuam sendo, produzidas. Além disto, entidades esportivas se empenham para elaboração de programas de conscientização e orientação dos atletas a respeito dos perigos desta prática.
Eritropoetina endógena
A eritropoetina (EPO) é um hormônio endógeno glicoprotéico de origem renal (90%) e hepática (10%) nos adultos e somente hepática no período embrionário5, 6. É composta por 165 aminoácidos e de duas a quatro cadeias sialiladas podem estar presentes em sua estrutura, devido aos três sítios de glicosilação N-ligados e à cadeia O-ligada que possui7, 8. Esses resíduos de ácido siálico constituem um sinalizador biológico da EPO, a fim de evitar que esta seja depurada pelo fígado antes que alcance seu alvo fisiológico2. Sua estrutura pode ser visualizada na figura 1. Também, devido aos resíduos de ácido N-acetilneuramínico (ácido siálico) que possui nas extremidades de cadeias glicídicas, a EPO possui carga negativa e um ponto isoelétrico (pI) que varia em torno de 4,5 a 5 10, 11.
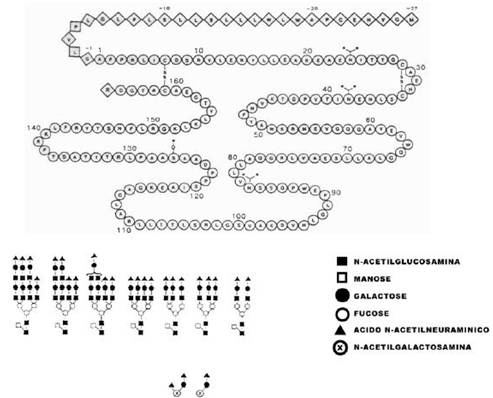
Figura 1. Estrutura química da EPO, uma glicoproteína com peso molecular de 160000 Da com 166 aminoácidos e duas
pontes dissulfídricas. Possui duas subunidades a e β. A EPO é composta por vários carboidratos e oligossacarídeos ligados.9
Este hormônio é o principal regulador da eritropoiese, estimulando a proliferação dos precursores eritróides medulares (figura 2), diminuindo seu tempo de maturação e, consequentemente, ocasionando um aumento da liberação de reticulócitos na corrente sanguínea, além de inibir a apoptose celular13. Sua síntese é estimulada perante um estado de hipóxia tecidual, já que é responsável pela diferenciação das células designadas ao transporte de oxigênio tecidual, os eritrócitos14. Quando esta baixa oxigenação tecidual mostra-se presente, a EPO é sintetizada e carreada pela corrente sanguínea até a medula óssea, ocasionando um aumento de eritrócitos na circulação. Em relação a este aumento eritróide, observa-se que ocorre em cerca de um a dois dias após o pico plasmático da EPO15, 16.
Desta forma, acredita-se que este hormônio atue sobre células próximas dos eritrócitos maturados, provavelmente as células formadoras de colônias de eritrócitos1, 2 e sabe-se que estas só respondem à EPO . Estudos mostram que, nestas células, o número de receptores para EPO é inferior a mil e, nos reticulócitos e hemácias maduras, eles não se encontram presentes1, 15. Estima-se que a meia-vida da eritropoetina, após o lançamento no sangue, seja de seis a oito horas e que seus níveis plasmáticos, no organismo humano, estejam em torno de 6,2 mU/mL (± 4,3)1, 2.
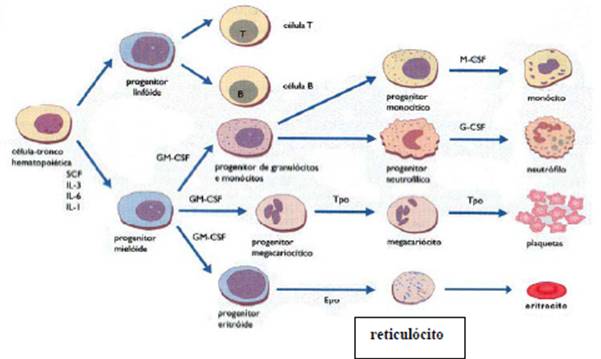
Figura 2. Sequência de proliferação, manutenção e maturação das células hematopoéticas ao nível da medula óssea,
a partir da célula tronco, com algumas FCHs envolvidas na sequencia de maturação da série mielóide. A EPO está envolvida
na seqüência de aparecimento das células da linhagem eritróide originado reticulócitos que originaram hemácias maduras.12
Eritropoetina Humana Recombinante (rHuEPO) e isoformas da EPO
EPO recombinante humana é uma glicoproteína altamente purificada, idêntica na seqüência de aminoácidos de eritropoetina endógena, produzida em escala elevada comercialmente graças ao advento da engenharia genética2. A EPO recombinante contém até 14 ácidos siálicos necessários para que o hormônio atinja os sítios-alvos na medula óssea, evitando a rápida metabolização hepática, influenciando, portanto, a meia-vida biológica na circulação e na eficácia terapêutica4.
A rHuEPO é utilizada para tratamento da anemia causada por insuficiência renal, restabelece os níveis de energia, melhorando qualidade de vida e tempo de sobrevida do paciente. Ultimamente está sendo utilizada em outros tipos de anemia, como as resultantes de pacientes submetidos a cirurgias17, pós-quimioterapia, associada ao HIV18 e anemia causada por neoplasias hematológicas, como o mieloma múltiplo19.
Atualmente, estudos com a rHuEPO estão sendo feitos para sua aplicação na redução da inflamação associada à isquemia em casos de lesão cerebral, da coluna vertebral, insuficiência renal aguda e infarto do miocárdio20.
Entretanto, a EPO aumenta acentuadamente a ativação endotelial e a reatividade plaquetária. O uso indevido por pessoas saudáveis pode conduzir a um aumento excessivo na hemoglobina, aumentando a viscosidade sanguínea, e por conseqüência, aumentando o hematócrito. Isso pode estar associado a complicações tromboembólicas, tais como isquemia e infarto do miocárdio, hemorragia cerebral e infarto, isquemia transitória, trombose venosa profunda, trombose arterial, embolia pulmonar, e trombose da retina2, 21 . Também está relatado aumento da pressão arterial, porém o mecanismo fisiopatológico desta elevação pressórica ainda não está esclarecido, e aumento do risco de desenvolver carcinoma hepático. Todavia, os efeitos em longo prazo ainda não são conhecidos, mas acredita-se haver um risco de desenvolvimento de desordens mieloproliferativas17.
Indivíduos que utilizam da rHuEPO podem desenvolver durante o tratamento uma deficiência de ferro, conseqüência do aumento da taxa de produção dos glóbulos vermelhos; neste caso, recomenda-se uma suplementação de ferro durante o tratamento com rHuEPO17.
As EPOs recombinantes são provenientes de diferente fontes de síntese em diferentes regiões do mundo2, desta forma são observadas diferenças significativas entre a composição de isoformas, propriedades biológicas e farmacocinéticas das rHuEPOs22. Estas diferenças devem-se a micro-heterogeneidade na estrutura do hormônio provocada pela variação na composição polissacarídica. Atualmente a rHuEPO está disponível para o uso terapêutico no mercado farmacêutico sob as formas: epoetina a, epoetina β, epoetina Ω2. Elas são classificadas de acordo com o método de fabricação, sendo as duas primeiras produzidas a partir do clone do gene humano da EPO expresso em células de ovário de hamster Chinês (CHO) e a última em células do rim de hamster jovem (BHK)7.
Um análogo a EPO recombinante humana foi desenvolvido por EGRIE & BROWNE (2001), a darbepoetina a (Aranesp®) uma versão hiperglicosilada da rHuEPO, a fim de demonstrar que com mais cadeias de carboidratos, a nova molécula apresentaria maior atividade biológica.
Na prática clínica, as vias intravenosa, subcutânea e intraperitoneal são as formas de administração mais comuns de rHuEPO. A escolha da via depende de considerações farmacocinéticas aliadas a aspectos de ordem prática2. Porém a melhor relação custo-benefício é a administração subcutânea subdividida em duas ou três vezes por semana23. Verifica-se que a eritropoiese é mais eficaz em resposta a injeções freqüentes com doses fracionadas de rHuEPO do que por picos intermitentes com grande dosagens. Entretanto, nenhuma das modalidades ou vias de administração exógena consegue reproduzir o padrão fisiológico de secreção ou ritmo circadiano do hormônio natural2.
Estudos demonstraram que o tempo de meia-vida na circulação da rHuEPO a após administração intravenosa é de 4 a 11 horas. A biodisponibilidade após administração subcutânea foi de 21% e o tempo para atingir a concentração máxima de 18 horas. Já a rHuEPO ß apresentou um tempo de meia-vida 20% superior à a após a administração intravenosa, e após administração subcutânea apresentou uma contagem absoluta de reticulócitos bem superior22. A versão análoga à rHuEPO, a darbepoetina, demonstrou meia-vida biológica no soro, aproximadamente três vezes superior, assim obtendo-se a mesma resposta biológica com menor freqüência na administração24.
Detecção laboratorial da rHuEPO e de outras formas sintéticas de EPO
Durante muito tempo, a detecção laboratorial da rHuEPO em atletas, assim como as outras formas de eritropoetina sintética, era algo impossível de se realizar, devido ao fato desta substância ser estruturalmente complexa e de elevada massa molecular, estar presente em baixas concentrações nos fluidos biológicos e ser bastante semelhante à forma endógena25, 26.
Desde 1990, a rHuEPO é oficialmente proibida pelo Comitê Olímpico Internacional, sendo que o primeiro teste para detecção deste hormônio sintético só foi realizado em 2000, nos Jogos Olímpicos de Sydney27. Atualmente, os únicos métodos para detecção da rHuEPO aceitos pela Agência Mundial Anti-Doping (World Anti-Doping Agency – WADA) são a focalização isolelétrica e double blotting, mesmo sabendo-se que estas metodologias não são totalmente eficazes na detecção de isoformas deste hormônio sintético e que possuem poucas chances de identificar algum resíduo de substância ilegal em amostra de uma pessoa que há alguns dias finalizou o uso da droga27, 28.
Além disto, muitas instituições também se valem da observação de índices hematimétricos, como valores de hematócrito, hemoglobina, presença de reticulocitose de macrocitose (achados que indicam eritropoiese acelerada) para avaliar os atletas submetidos à análise anti-doping2. A União Internacional de Ciclismo e a União Internacional de Esqui, por exemplo, em relação aos índices hematimétricos, estabeleceram valores máximos de hematócrito e hemoglobina: 50% e 17 g/dL, respectivamente, para mulheres, e 50% e 18,5g/dL para homens17.
Em relação aos índices hematimétricos, existem dois modelos matemáticos para sua utilização: o ON (destinado a usuários recorrentes de rHuEPO) e o OFF (para possível identificação de um atleta que suspendeu a utilização da EPO recentemente26, 29, 30. Apesar disto, sabe-se que não são boas fontes confirmatórias de doping, já que esses valores, por sofrerem alteração de diversas variáveis (como exemplo, a altitude do local onde o esportista reside e/ou treina) podem diferir muito de um indivíduo para o outro. Porém, as provas laboratoriais, mesmo que com algumas deficiências, são capazes de detectar grande número de amostras que possuem indícios de uso de EPO sintética pelo doador do material biológico.
O método considerado padrão-ouro para detecção da rHuEPO, principalmente, além da darbepoetina e outras isoformas, é a Focalização Isoelétrica seguida de Double Blotting, em amostra urinária2, 27, 31. Este método torna possível a identificação de formas sintéticas da EPO devido à diferença de pH , está baseado em diferenças existentes entre os resíduos de carboidratos da rHuEPO e da EPO fisiológica. Na focalização isoelétrica, a eritropoetina endógena apresenta bandas, com pH de 3,92 a 4,42, enquanto que as formas a e ß de rHuEPO apresentam pI na faixa de 4,42 a 5,11 e a darbepoetina tem seus valores de pI em torno de 3.7 – 427, 32. A figura 3 ilustra diferentes bandas de formas sintéticas de EPO.
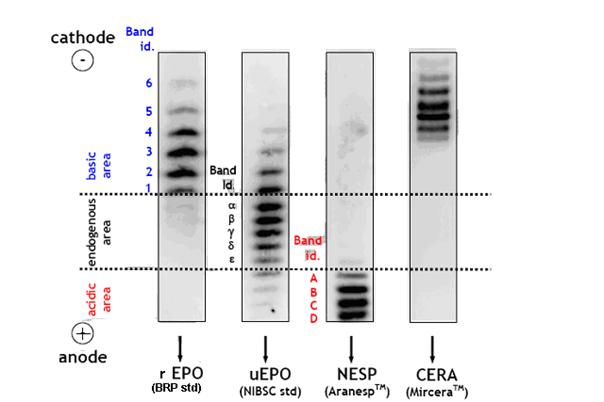
Figura 3. Imagem das diferentes bandas obtidas através de quimiluminescência em análise de eritropoetina. 31
Apesar de esta metodologia possuir uma fundamentação consistente, ainda sofre com muitos interferentes e variáveis. A exemplo disto, temos o atleta que, em torno de uma semana antes da avaliação, cessa o uso da EPO sintética. Como esta possui uma meia-vida pouco considerável no plasma sanguíneo, o infrator tem grandes chances de não ser identificado por seu ato, já que a metodologia utilizada pode não ser capaz de identificar a substância do doping2.
Não obstante a estes pontos defasados, a identificação laboratorial da EPO está em constante desenvolvimento, e formas, que não o padrão-ouro, tem mostrado igual eficácia nos resultados. Inúmeros estudos publicados conotam a diversas outras metodologias que, comprovadamente, realizam a detecção da EPO sintética. A exemplo disto, temos testes baseados em anticorpos mono ou policlonais anti-EPO humana, utilização de marcadores fisiológicos, investigação por cromatografia líquida, análise de marcadores gênicos eritróides, entre muitos outros2, 7, 28, 33.
Dados estatísticos relacionados ao doping por eritropoetina
A Agência Mundial Anti-Doping (World Anti-Doping Agency – WADA), responsável por normatizar a metodologia de detecção da eritropoetina sintética em atletas praticantes de diversas modalidades esportivas, disponibiliza, periodicamente, documentos que fornecem dados acerca da estatística referente ao o uso desta substância de forma ilegal.
Este trabalho, mostra dados retrospectivos da utilização da rHuEPO no período de 2003 a 2007, e analisa se um decréscimo de seu uso está ocorrendo ou não, já que campanhas de conscientização sobre os efeitos adversos de seu uso indevido vem sendo realizadas por diversos órgãos internacionais17.
-
2003: amostras de 151.210 atletas, de diversas partes do mundo e praticantes das mais diversas modalidades esportivas, foram analisadas, sendo que destas, 2716 continham alguma substância ilegal. Destas amostras com resquícios de ilegalidade, um total de 79 apresentou positividade para presença de hormônios peptídicos (grupo no qual se encontra a rHuEPO – S5), o que corresponde a 2,9% do total de testes positivos realizados. A representatividade da eritropoetina e darbepoetina no grupo S5 foi, respectivamente, de 64,6% e 8,9%, geradas a partir de 51 e 7 amostras de cada substância, conforme mostra a tabela 131.
-
2004: amostras de 169.187 atletas de modalidades olímpicas e não olímpicas foram analisadas, com positividade de doping em 3305. Destas 3305, 78 foram positivas para hormônios peptídicos (grupo S5) , correspondendo a 2,4% do total dos testes. Dentre estas amostras do grupo S5, a eritropoetina contribui com 48,7%, ou seja, 38 amostras. Estes dados podem ser observados na tabela 231.
-
2005: das 183.337 amostras analisadas, 4298 foram positivas para substâncias ilegais. Dentre estas, 3,8% (162 amostras) pertenciam ao grupo de hormônios (S2), no qual se encontra a eritropoetina e a darbepoetina. A EPO, no grupo S2, representou 9,3% (15 amostras) das amostras positivas, enquanto que a darbepoetina contribuiu com apenas 0,6% (1 amostra), o que fica evidenciado na tabela 331.
-
2006: 198.143 atletas foram testados em relação à presença de substâncias ilícitas, com resultados positivos em 4332. Destes positivos, apenas 1% (42 amostras) foram relacionadas a hormônios (grupo S2). A eritropoetina, com 17 amostras, representou 40,5% deste grupo e, com uma amostra, a darbepoetina correspondeu a 2,4%., conforme pode ser confirmado na tabela 431.
-
2007: amostras de 223.898 atletas, de diversas modalidades esportivas, foram analisadas, sendo que 4850 continham alguma substância ilegal. Destas amostras, 41 apresentaram positividade para presença de hormônios peptídicos (grupo no qual se encontra a rHuEPO – S2), o que corresponde a 0,8% do total de testes positivos realizados. A representatividade da eritropoetina e darbepoetina no grupo S2 foi, respectivamente, de 53,7% e 4,9%, geradas a partir de 22 e 2 amostras de cada substância, conforme mostra a tabela 531
Conclusão e implicações para o futuro
Mesmo possuindo um potencial de causar riscos à saúde, formas exógenas de eritropoetina, que proporcionam melhora no condicionamento físico devido à influência sobre o sistema hematopoiético, são usadas por atletas que visam melhores resultados na prática esportiva, principalmente em modalidades de “endurance” 1.
Com o intuito de controlar este tipo de doping, várias organizações mundiais desenvolvem estratégias para prevenir e detectar de forma eficaz a presença de EPO sintética. Porém, ainda há muito que se descobrir e aplicar. Técnicas recentes como o doping genético, onde uma cópia do gene que codifica a eritropoetina é adicionado no esportista, são praticamente indetectáveis, embora alguns estudos sugerem que é possível diferenciar, por meio do padrão de glicosilação protéico, a eritropoetina produzida pelo gene nativo da produzida pelo gene transferido34, 35, 36.
A partir da análise dos dados fornecidos pelas tabelas 1 – 4 se observa uma diminuição de resultados positivos para doping por formas clássicas de EPO exógena. Porém, novas metodologias ilícitas para melhora na performance surgem periodicamente, enquanto que as técnicas continuam defasadas, e necessitam cada vez mais serem aperfeiçoadas para se obter uma maior confiabilidade dos resultados obtidos2, 37, 31.
Tabela 1. Dados fornecidos pela WADA referentes aos resultados de testes anti-doping realizados no ano de 2003 31
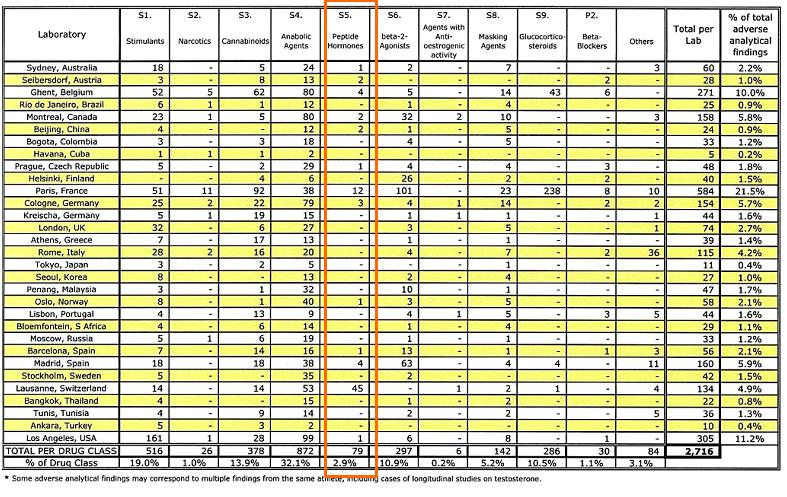
Tabela 2. Dados fornecidos pela WADA referentes aos resultados de testes anti-doping realizados no ano de 2004 31
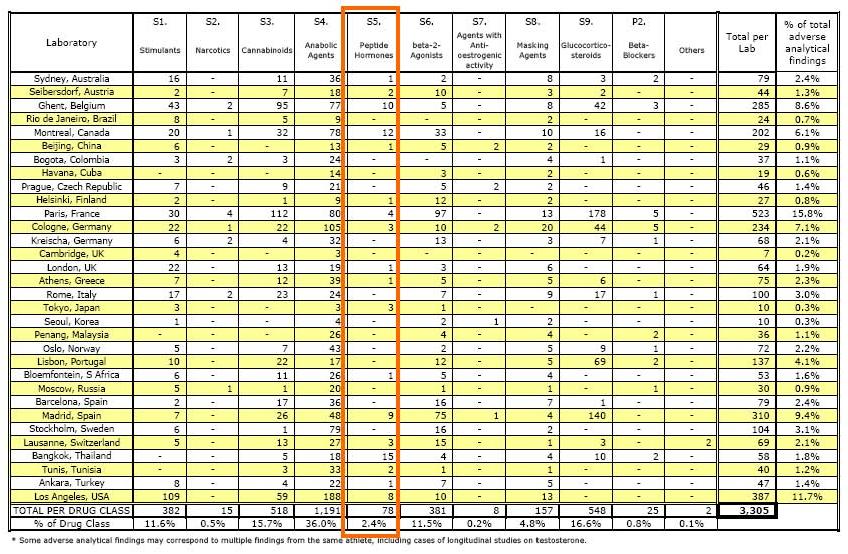
Tabela 3. Dados fornecidos pela WADA referentes aos resultados de testes anti-doping realizados no ano de 2005 31
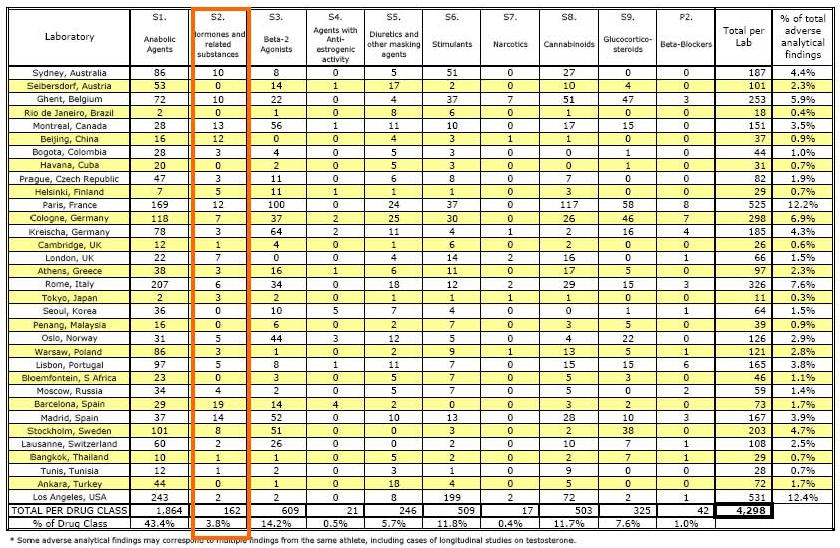
Tabela 4. Dados fornecidos pela WADA referentes aos resultados de testes anti-doping realizados no ano de 2006 31
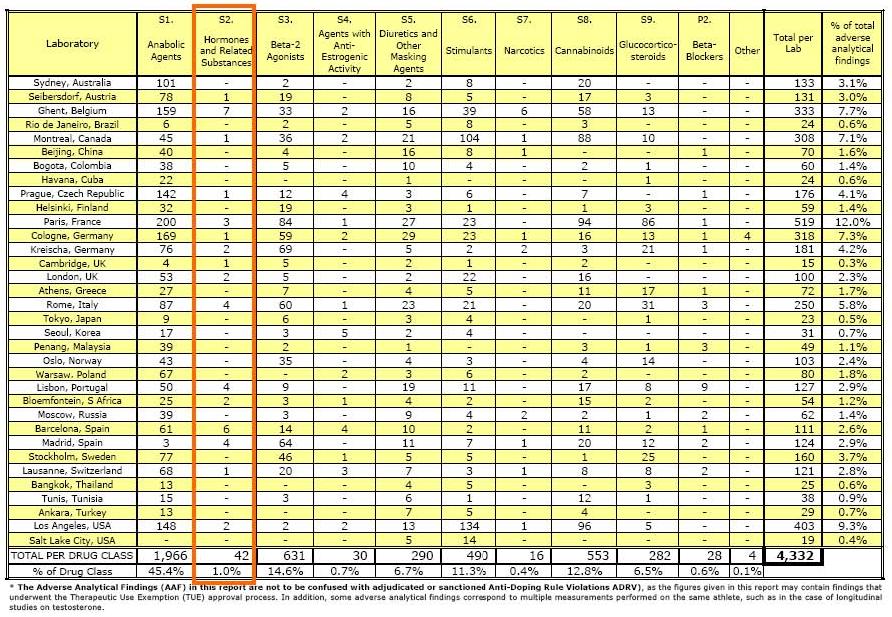
Tabela 5. Dados fornecidos pela WADA referentes aos resultados de testes anti-doping realizados no ano de 2007 31
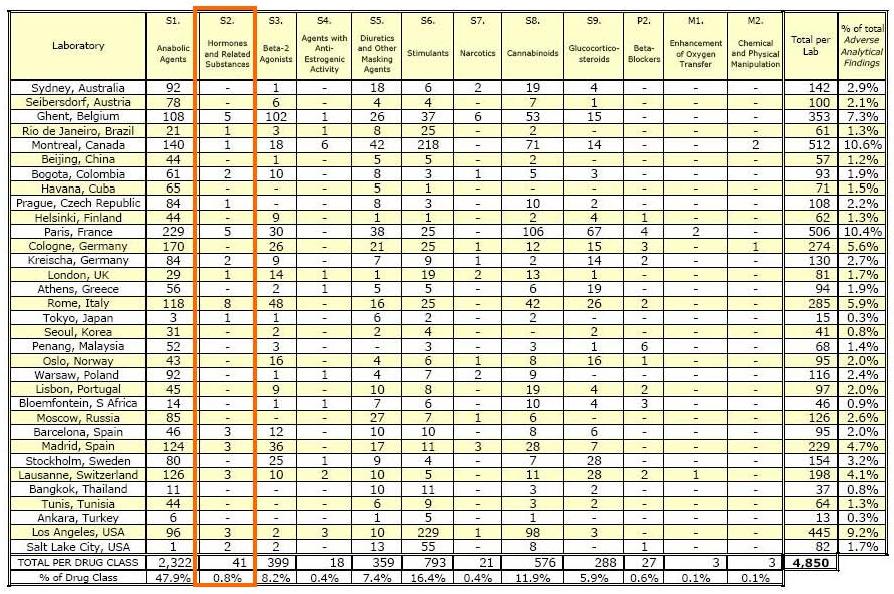
Referências
-
Cruz, AM. Resistência aeróbia e eritropoetina. Estudos, Goiânia, v. 33, n.7/8, p. 553-572, jul./ago. 2006.
-
Bento, R.M.A. et al. Eritropoetina humana recombinante no esporte: uma revisão. Rev Bras Med Esporte _ Vol. 9, Nº 3 – Mai/Jun, 2003.
-
Federation Internationale de Football Association – FIFA. http://www.fifa.com/aboutfifa/developing/medical/newsid=514035.html
-
Choi D, Kim M, Park J. Erythropoietin: physico and biochemical analysis. J Chromatogr B 1996;687:189-99.
-
Adamson JW. Regulation of red blood cell production. Am J Med 1996;101:S4-6.
-
Gareau R, Audran M, Baynes RD, Flowers CH, Duvallet A, Senécal L,et al. Erythropoietin abuse in athletes. Nature 1996;380:113.
-
Schmidt, C. et al. Avaliação da Atividade e Caracterização de Eritropoietina Humana Recombinante em Produtos Farmacêuticos. Arq Bras Endocrinol Metab vol 47 nº 2 Abril 2003.
-
Browne, J. K. et al. Erythropoietin: gene cloning, protein structure, and biological properties. Cold Spring Harbor Symposia On Quantitative Biology, v. 51, p. 693-702, 1986.
-
Gild D., Riedl B., Zier A., Zimmermann M. F. Analytical methods for characterization and quality controlo f Pharmaceutical peptides and proteins, using erythropoetin as na exemple. Pharmac. Acta Helvetiae.71, p. 383-394, 1996.
-
Cheetham, J.C. et al. NMR structure of human erythropoietin and a comparison with its receptor bound conformation. Nature Structural Bilogy, v.5, n. 10, p. 861-866, 1998.
-
Lasne, F. et al. Detection of recombinant human erythropoietin in urine for doping analysis: Interpretation of isoelectric profiles by discriminant analysis. Electrophoresis 2007, 28, 1875–1881.
-
Rang H., Dale M.M, Ritter J. M. Farmacologia Integrada. 4ª edição. Editora Manole Ltda 1999.
-
Lacombe, C.; Mayeux, P. Biology of erythropoietin. Haematologica, v. 83, p. 724-732, 1998.
-
Baptista, CA et al. Drogas lícitas e ilícitas nas academias e no esporte. Rev Soc Cardiol Estado de São Paulo — Vol 15 — No 3 — Maio/Junho de 2005
-
Alberts B, Bray D, Lewis J, Raff M, Roberts K, Watson JD. Molecular biology of the cell. 3rd ed. New York: Garland Publishing, 1994
-
Oliveira MAB. Doping e coração. Rev SOCERJ 2000;13:53-60
-
Cazzola, M. A global strategy for prevention and detection of blood doping with erythropoietin and related drugs. Haematologica 2000; 85:561-563
-
Fischl CA, Galpin JE, Levine JD, Groopman JE, Henry DH, Kennedy P, et al. Recombinant human erythropoietin therapy for AIDS patients treated with AZT: a double-blind, placebo controlled clinical study. N. Engl. J. Med. 1990; 322:1488-1493.
-
Raine AEG, Dphil FRCP, Roger SD. Effects of erythropoietin on blood pressure. Am. J. Kidney Dis. 1991;18:76-83
-
Sharples E. J.; Thiemermann C.; Yaqoob M. M. Novel applications of recombinant erythropoetin. Current Opinion in Pharmacology, v. 6, p. 184-189, 2006
-
Produtos Roche químicos e Farmacêuticos S.A NEORECORMON® - Eritropoetina Beta. Rio de Janeiro: Roche
-
Halstenson C. E. et al. Comparative Pharmacokinetics and pharmacodynamics of epoetin alfa and epoetin beta. Clinical Pharmacology & Therapetics, v. 50, n.. 6, p. 702-712, 1991
-
Ramos A. S. Avaliação biológica, físico-quimica e imunológica da eritropoetina humana recombinante. 2001, 129 f. Dissertação (Mestrado em ciências farmacêuticas)- Universidade Federal de Santa Maria, Santa Maria, 2001
-
Allon M. et al. Pharmacokinetics and pharmacodynamics of darbepoetin alfa and epoetin alfa in patients undergoing dialysis. Clinical Pharmacology & Therapetics, v.72, p 546-555, 2002
-
Magnani M, Corsi D, Bianchi M, Paiardini M, Galluzi L, Parisi A, et al. Monitoring erythropoietin abuse in athletes. Br J Haematol 1999;106:260-1
-
Gareau R, Brisson GR, Chénard C, Gagon MG, Audran M. Total fibrin and fibrinogen degradation products in urine: a possible probe to detect illicit users of the physical-performance enhancer erythropoietin? Horm Res 1995;44:189-92
-
River L, Saugy M. Peptides hormones abuse in sport: state of the art in the detection of growth hormone and erythropoietin. J Toxicol-Toxin Reviews. In press 2003.
-
Marie, E. V.; Audran, M.; Lejeune, M.; Bonafoux, B.; Sicart, M.T.; Marti, J.; Piquemal, D.; Commes, T. Analysis of human reticulocyte genes reveals altered erythropoiesis: potential use to detect recombinant human erythropoietin doping. Haematologica 2004; 89(8): 991-997, August 2004.
-
Parisotto R, Gore CJ, Emslie KR, Ashenden MJ, Brugnara C, Howe C, et al. A novel method utilizing markers of altered erythropoiesis for the detection of recombinant human erythropoietin abuse in athletes. Haematologica 2000;85:564-72.
-
Kazlauskas R. Sydney Olympics 2000: an overview. In: Schänzer W, Geyer H, Gotzmann A, Mareck-Engelke U, editors. Recent advances in doping analysis . Köln: Sport und Buch Strauβ, 2001;167-77.
-
World Anti-Doping Agency - WADA. (http://www.wada-ama.org/en/)
-
Lasne F, de Ceaurriz J. Recombinant erythropoietin in urine. Nature 2000;405:635.
-
Joyner MJ et al. Second generation blood tests to detect erythropoietin abuse by athletes: effective but not preventive? Haematologica/the hematology journal | 2004; 89 (online) | 39 |
-
Diamanti-Kandaraskis E, Konstantinopoulus P, Papailiou J, Kandaraskis AS, AndreopoulusA, Sykiotis G. Erytropoietin abuse and erytropoietin gene doping. Sports Med. 2005;35:831-40.
-
Lasne F, Martin L, de Ceaurriz J, Larcher T, Moullier P, Chenuaud P. “Genetic doping” with erythropoietin and cDNA in primate muscle is detectable. Mol Ther.2004;10:409-10 .
-
Artiolli, G.G.; Hirata, R.D.C.; Lancha, A.H.J. Terapia gênica, doping genético e esporte: fundamentação e implicações para o futuro. Rev Bras Med Esporte _ Vol. 13, Nº 5 – Set /Out, 2007.
-
Cazzola, M. Further concerns about the medical risks of blood doping. Haematologica vol. 87(3), p 232.march 2002.
Outros artigos em Portugués
 |
|
|---|---|
|
revista
digital · Año 14 · N° 134 | Buenos Aires,
Julio de 2009 |
|