
|
|||
|---|---|---|---|
|
|
Exercício, fosfatidilcolina e depósitos de gordura em ratos Phosphatidylcholine and fat depots |
|
|
|
Unesp Campus Rio Claro, São Paulo. (Brasil) |
José Diego Botezelli Fabrício Azevedo Voltarelli | Maria Alice Rostom de Mello jdbotezelli@yahoo.com.br |
|
|
|
|
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 13 - N° 122 - Julio de 2008 |
|
|
1 / 1
Introdução
A obesidade está diretamente associada, nos dias atuais, ao aumento do índice de mortalidade. A taxa de mortalidade aumenta expressivamente quando o IMC esta entre 27 e 40 kg/m2. Nesta faixa, a perda de peso em pequenas quantidades pode reduzir a taxa de mortalidade. Por volta de 20 a 25% dos homens e 30% das mulheres nos EUA apresentam índice de massa corporal (IMC) maior ou igual a 30 kg/m2. Isso se torna bastante relevante à medida que aproximadamente 50% dos indivíduos com IMC maior que 30 kg/m2 são diabéticos ou apresentam intolerância a glicose. Alem disso, estima se que 300000 mortes ocorram a cada ano ligado a obesidade, tornando-a a segunda maior causa de mortalidade prematura nos EUA, sendo a primeira o hábito de fumar1.
Nos últimos anos estabeleceram-se diversas causas para a obesidade, entre elas fatores genéticos, psicológicos, fisiológicos e, especialmente, hábitos alimentares inadequados associados a um estilo de vida sedentário. O maior problema incide no fato da obesidade não ser uma doença independente. Encontra-se sempre associada a outras patologias como doenças cardiovasculares, diabetes, lesões articulares; além de ter conseqüências estéticas, que podem levar a diversos problemas psicológicos como depressão, estresse, anorexia, e a mais nova, vigorexia2.
Outro problema associado ao excesso de ganho de peso é a gordura localizada. O procedimento mais usado para a remoção desses depósitos de gordura é a lipoaspiração3. Além de exercícios e processos cirúrgicos, diversas outras técnicas de tratamento vêm sendo utilizadas no combate aos depósitos localizados de gordura, incluindo alguns medicamentos. Um desses medicamentos que vem sendo utilizado há algum tempo, em associação ou não com exercício físico, é o Lipostabil®, cujo princípio ativo é a fosfatidilcolina4.
A Fosfatidilcolina é um fosfolipídio emulsificante, que possui ação detergente e diminui a tensão superficial, formando partículas menores de gordura na forma de triglicerídeos5. Isso causa alteração na forma do adipócito, o que pode explicar a redução de medidas nos locais onde a fosfatidilcolina foi aplicada.
Na atualidade já foram iniciadas investigações científicas, no sentido de desvendar o provável mecanismo de ação lipolítica da fosfatidilcolina nos adipócitos de animais e de humanos. Uma das hipóteses a ser considerada, é a de que a fosfatidilcolina penetra no adipócito graças a seu caráter anfipático. No citoplasma, a hidrólise da fosfatidilcolina pela fosfolipase D gera o ácido fosfatídico, que levaria a ativação da proteinaquinase C (PKC). Esta última ativaria a translocação da lípase sensível ao hormônio (LSH), desde o citoplasma do adipócito até o vacúolo que contém os triglicerídeos. Assim, o LSH hidrolisaria os triglicerídeos em ácido graxos e glicerol, que seriam posteriormente utilizados em outras vias metabólicas e eliminados em pequenas quantidades pelo aparelho urinário. Outra hipótese sugere a ativação de receptores específicos de membrana e a destruição de adipócitos. Essa última seria desencadeada pela ativação da via inflamatória [fosfolipase D e o fator de necrose tumoral alfa, (TNF-α)], ou por uma ação irritante da fosfatidilcolina nos adipócitos6,7.
Os estudos sobre os efeitos medicinais da fosfatidilcolina são voltados principalmente para as doenças coronárias8, mas há evidências de efeitos positivos também no fígado9 e cérebro10. Contudo, ainda há controvérsias em relação a estes resultados.
Em relação ao acúmulo tecidual de gordura, existe o relato de um estudo feito em animais11, onde a deficiência de fosfatidilcolina foi relacionada a distúrbios na liberação de lipídeos pelas células. Neste estudo, ratos recebiam dietas ricas ou pobres em colina durante duas semanas. Quando a quantidade de colina era baixa, havia distúrbios na liberação de gordura das células do intestino para o sistema linfático. A suplementação oral de fosfatidilcolina rapidamente corrigiu esta disfunção, confirmando a colina como um fator extremamente importante na absorção de gorduras através da membrana celular.
Embora a forma injetável de fosfatidilcolina não tenha sido aprovada para fins cosméticos no Brasil, existem evidências clínicas de sua eficácia no tratamento da gordura localizada4,12. O medicamento tem sido amplamente utilizado no Brasil em diversas condições clinicas onde existem depósitos de gordura em tecidos subcutâneos12.
Receosa quanto ao emprego da fosfatidilcolina no tratamento de depósitos localizados de gordura, a Agencia Nacional de Vigilância Sanitária (ANVISA), que regulamenta o uso do medicamento no Brasil, publicou uma resolução em 9 de janeiro de 2003, proibindo o uso cosmético ao nível nacional da forma comercial do produto Lipostabil® (AVENTIS PHARMA). Contudo, a forma manipulada do medicamento não possui nenhum tipo de regulamentação, fato que aumentou a procura pela fosfatidilcolina na forma manipulada. Recentemente o uso cosmético da fosfatidilcolina espalhou-se além das clinicas médicas, chegando até as academias e salões de beleza.
Do exposto anteriormente, conclui-se a urgência da realização de pesquisas visando a ampliar os conhecimentos sobre os efeitos da aplicação da fosfatidilcolina com objetivos cosméticos.
ObjetivoO presente estudo foi delineado para avaliar os efeitos da fosfatidilcolina, associada ou não ao exercício, sobre adiposidade corporal e teores de gordura de diferentes tecidos em modelo experimental utilizado em ratos.
Materiais e métodoAnimais e seu tratamento
Foram utilizadas ratas, a linhagem wistar, adultas (90dias), que foram mantidas em gaiolas coletivas (5 animais por gaiola), em ciclo claro escuro 12/12 horas, com livre acesso a água e ao alimento (ração comercial para roedores). Todos os experimentos envolvendo os animais seguiram O Instituto de Biociências não possui um comitê de ética em animais, por isso as resoluções adotadas serão as resoluções brasileiras específicas sobre Bioética de Experimentos com Animais (lei nº 6.638 de 08 de maio de 1979 e decreto no 6.638, de 10 de julho de 1934, Colégio Brasileiro de Experimentação Animal).
Delineamento e grupos experimentaisO experimento teve a duração de 6 semanas e os animais foram separados aleatoriamente em quatro grupos;
Controle - C
Controle exercitado - CE
Tratado com fosfatidilcolina - T
Tratado com fosfatidilcolina e exercitado - TE
Tratamento com a fosfatidilcolinaA partir dos 90 dias, as ratas designadas aos grupos T e TE receberam a fosfatidilcolina (Lipostabil®, AVENTIS PHARMA; Milão, Itália), via subcutânea, na concentração 50mg/ml. A droga foi aplicada, usando seringas de insulina com agulhas 360 ½, na região dorsal do animal. Foram injetados 2,5ml (125mg/2,5ml), distribuídos uniformemente em uma área de cerca de 40cm2. Para que a distribuição fosse uniforme, a área tratada foi dividida em 4 regiões e, aproximadamente, 0,6 ml foi injetado em cada região. Todo o procedimento foi realizado com o rato sob anestesia com éter. Cada animal foi submetido a 4 aplicações, com intervalo de uma semana entre elas. Decorridas 2 semanas da ultima aplicação os animais foram sacrificados para analises de material biológico. Esse trabalho não contou com nenhum apoio financeiro do laboratório AVENTIS PHARMA e os autores não mantêm nenhum vínculo com o mesmo.
Exercício físicoAs ratas designadas aos grupos CE e TE foram submetidas à natação, 5 dias por semana, e uma vez ao dia, em tanque coletivo com água a 30 ± 2 ºC, suportando sobrecarga de 5% do peso corporal durante oito semanas. Esse protocolo foi escolhido por corresponder a exercício aeróbio moderado para ratos13.
AvaliaçõesTodos os animais foram pesados e tiveram a ingestão alimentar registrada uma vez por semana nas 4 primeiras semanas. Decorridas as 8 semanas e 48 horas após a realização da última sessão de exercício, os animais foram sacrificados, sem jejum prévio, para a coleta dos seguintes tecidos, visando análises bioquímicas:
Sangue : glicose, ácidos graxos livres (AGL), colesterol total, colesterol HDL, colesterol LDL e triglicerídeos;
Tecido adiposo subcutâneo anterior, retroperitonial e mesentérico: peso total e lipídeos totais;
Fígado: glicogênio, lipídeos totais;
Músculo gastrocnêmico esquerdo (porção mista): peso total, lipídeos totais, glicogênio;
A excisão dos diferentes depósitos de gordura foi realizada de acordo com a descrição de Cinti14. Glicose, AGL, Colesterol total, colesterol HDL, colesterol HDL e Triglicerídeos séricos foram analisados pelos procedimentos descritos por Nogueira et al15. O glicogênio tecidual foi dosado pelo método do fenol16 e a determinação dos lipídios foi feita de acordo com Nogueira et al15.
ResultadosNão houve diferença significativa de peso entre os grupos ao final do experimento (C= 276.8 ± 22; T= 250.3 ± 13.9; CE= 258.3 ± 18.6; TE= 276.3 ± 18.9 ). A ingestão alimentar de todos os grupos variou bastante ao longo do experimento. Ao final,os grupos exercitados apresentaram menor ingestão do que os sedentários (C= 62.5 ± 0.7; T= 55 ± 1.4; CE= 45 ± 4.2; TE= 45 ± 4.24, ANOVA, p<0,05).
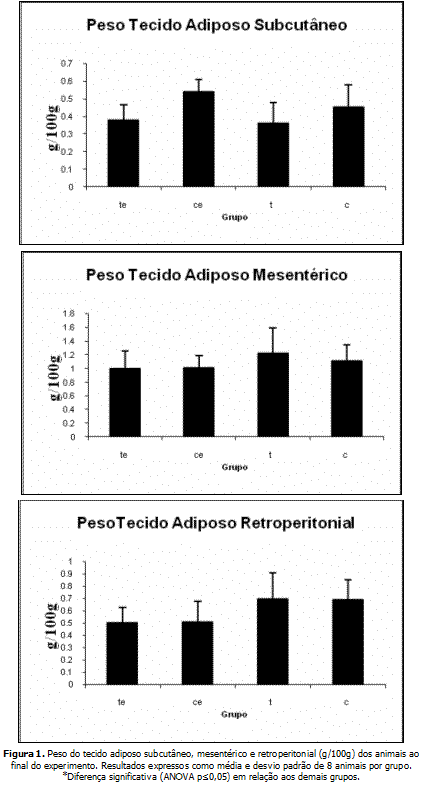
A figura 1 mostra o peso do tecido adiposo subcutâneo, mesentérico e retroperitonial. Houve, no tecido adiposo subcutâneo, uma ligeira redução de peso no grupo TE em relação aos demais.
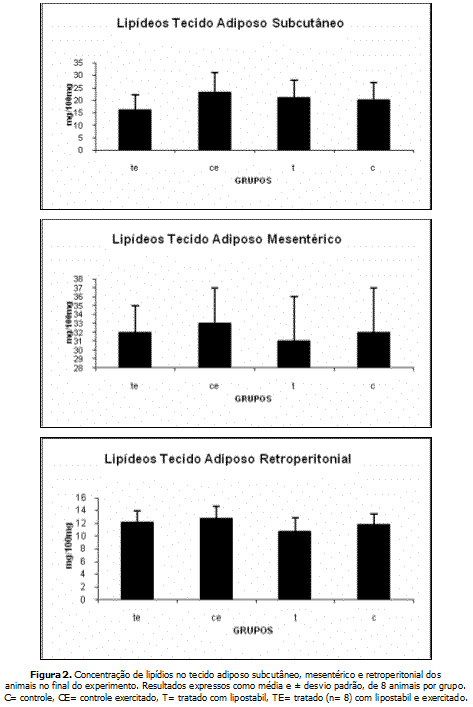
A figura 2 mostra as concentrações de lipídeos em diferentes regiões de tecido adiposo dos animais. Não houve diferença significativa entre os grupos em todas as regiões examinadas. Contudo, o tecido adiposo subcutâneo apresentou ligeira redução de peso no grupo TE em relação aos demais.
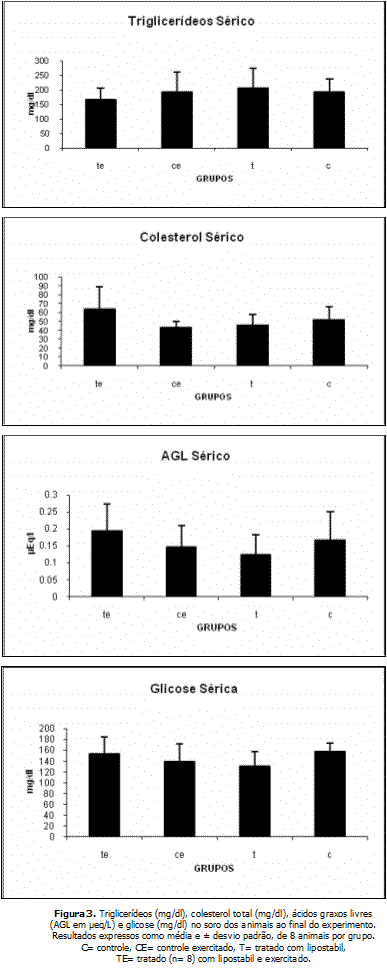
A figura 3 mostra as concentrações de Triglicerídeos, AGL, Colesterol e glicose sanguíneos. Não houve diferença significativa entre os grupos.
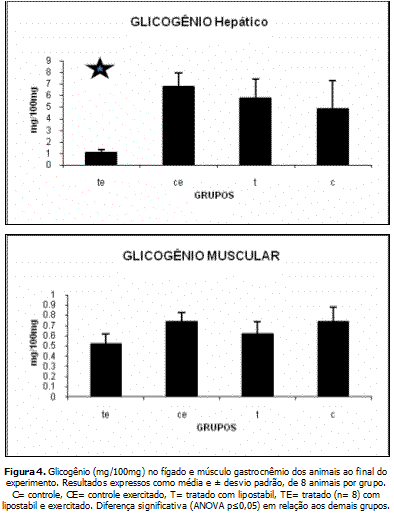
A figura 4 mostra as concentrações de Glicogênio muscular e hepático. Houve redução significativa no grupo TE perante aos demais.
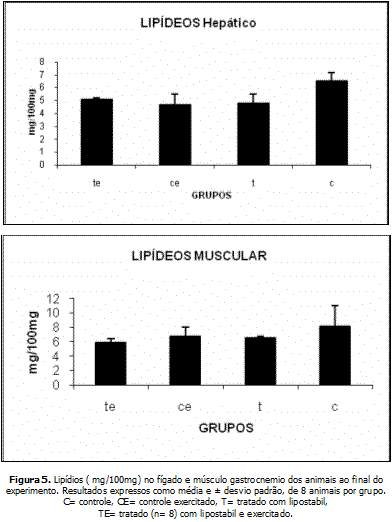
A figura 5 mostra as concentrações de lipídeos muscular e hepático. Houve redução significativa em todos os grupos quando comparado ao grupo controle.
DiscussãoRecentemente, em função de matérias veiculadas na imprensa destacando o uso do medicamento Lipostabil® para fins estéticos, a Aventis Pharma, laboratório responsável pela distribuição do medicamento Lipostabil®, fez os seguintes esclarecimentos: "Lipostabil® é a marca comercial do medicamento fosfatidilcolina, comercializado pela Aventis Pharma na Itália e na Alemanha, entre outros países. Trata-se de medicamento cardiovascular, para a profilaxia e tratamento da embolia gordurosa e de uso exclusivamente endovenoso. Não existem estudos clínicos que comprovem a eficácia e a segurança do produto na dissolução de gorduras localizadas. Os efeitos colaterais em longo prazo pelo uso deste produto ainda não são conhecidos". Na nota, afirmava-se ainda que a Aventis Pharma Brasil não comercializa o referido produto no país e tampouco tem vínculo e/ou responsabilidade sobre a comercialização que atualmente ocorre com Lipostabil®. A empresa, porém, alerta para os riscos decorrentes do uso inadequado do medicamento. Preocupada com eventuais riscos e conseqüências a que se sujeitam usuários que utilizam erroneamente o produto, a Aventis Pharma Brasil tomou a iniciativa de informar as autoridades sanitárias sobre os fatos17.
A Agência Nacional de Vigilância Sanitária (ANVISA), no dia 30 de dezembro de 2002, por sua vez, divulgou notícia em seu site na internet na qual alerta os consumidores, profissionais médicos, proprietários de clínicas de estética e farmácias de manipulação de que o medicamento Lipostabil® (fosfatidilcolina) não está registrado na ANVISA e por isso não existe autorização para fabricação, importação, distribuição, venda e uso desse produto no país. O medicamento vem sendo usado clandestinamente em diversas clínicas brasileiras com uma indicação não comprovada de redução de gorduras localizadas e tratamento estético17.
A Aventis Pharma afirma que "devido à ausência de estudos clínicos para a indicação estética, não há como assegurar a utilização do produto, via aplicação subcutânea, sem que haja riscos em relação à dissolução exagerada de gordura ou a desnutrição de outros tecidos além das células adiposas". Além disso, existem riscos conhecidos da fosfatidilcolina apresentados como náuseas, queimação, anorexia, diarréia, depressão, ganho de peso, arritmias, hipotensão e fraqueza O Lipostabil® não oferece garantia de eficácia nem de segurança. Alimentação adequada e exercícios físicos bem orientados são as melhores maneiras de perder gordura corporal, inclusive as gorduras localizadas. Medicamentos antiobesidade podem ser úteis auxiliares em casos selecionados. A cirurgia bariátrica é um recurso extremo para casos mais graves17.
Por essa razão, no presente estudo foram avaliados os efeitos do Lipostabil®, aplicada por via subcutânea, associada ou não ao exercício, sobre a gordura subcutânea e o teor de lipídios de diferentes órgãos, em modelo experimental utilizado ratos.
O tratamento com lipostabil não alterou o teor de lipídios viscerais (tecido adiposo mesentérico e retroperitonial), porém, tendeu a reduzir a concentração de lipídios no tecido adiposo subcutâneo anterior. A alteração não atingiu marcas significativas, talvez em função do número relativamente pequeno de animais avaliados.
Por outro lado, estudos mostram forte associação entre obesidade e inatividade física18-20, bem como associação inversa entre atividade física, índice de massa corpórea (IMC), razão cintura-quadril (RCQ) e circunferência da cintura21-23. Tais estudos demonstram que os benefícios da atividade física para a perda de peso podem ser alcançados com intensidades baixa, moderada ou alta, indicando que a manutenção de um estilo de vida ativo, independente da atividade praticada, pode combater o desenvolvimento dessa doença.
Para a redução do peso corporal, é necessário que o gasto energético supere o consumo diário, o que pode sugerir que a simples redução na ingestão calórica, através de dieta alimentar, seja suficiente. No entanto, o problema é mais complexo. Tem sido relatado que alteração no estilo de vida, através de aumento na quantidade de atividade física praticada e reeducação da ingestão alimentar, consiste no melhor tratamento22.
No presente estudo, os animais dos grupos treinados foram submetidos ao exercício de natação suportando carga equivalente a 5% do peso corporal. Essa sobrecarga foi escolhida por representar exercício aeróbio de intensidade moderada para ratos13. Nenhuma alteração alimentar foi imposta aos animais. O treinamento não interferiu no ritmo de ganho de peso durante o experimento, mas provocou ligeiro decréscimo na ingestão de alimentos.
Dentre os parâmetros sanguíneos avaliados após o sacrifício dos animais, não foram constatadas quaisquer diferenças significativas entre os grupos quanto ao perfil lipídico. Em revisão a respeito do efeito do exercício sobre o perfil lipêmico tanto de indivíduos saudáveis quanto em portadores de cardiopatias23, concluiu que a maioria dos estudos não sustenta a hipótese de que indivíduos adultos, quando submetidos a programas de exercícios aeróbios moderados apresentem redução significativa do colesterol total ou no colesterol das LDL-C bem como aumento significante nas concentrações circulantes de HDL-C.
A manutenção do peso corporal durante programa de exercícios geralmente associa-se a modestas alterações no perfil lipêmico, como pequena redução no colesterol total e LDL-C e pequeno aumento do HDL-C24. De acordo com Bar-or et al24, as mudanças mostrar-se-iam mais pronunciadas mediante perda de peso em decorrência do programa de exercício. Contrariamente, o ganho de peso durante o programa associar-se-ia com mudanças indesejáveis do perfil lipêmico.
A aplicação subcutânea de lipostabil também não interferiu na colesterolemia, visto que os valores de colesterol total, LDL e HDL encontrados para os grupos trados com a droga (T e TE) em nada diferiram daqueles dos controles (C e CE.).
A concentração sérica de triglicerídeos dos animais controles exercitados (CE) não foi diferente dos correspondentes sedentários (C), divergindo da literatura, que25 relata que a atividade física tem efeito benéfico sobre o perfil lipêmico, embora em indivíduos normolipêmicos este efeito esteja associado a reduções das concentrações circulantes de triglicérides, sem alterações nas de colesterol total.
Também o tratamento com lipostabil não interferiu na concentração sérica de triglicerídeos. Considerando-se que a coleta de sangue foi realizada sem jejum prévio dos animais, os resultados podem ter sofrido interferência do processo absortivo de lipídios, pois os triglicerídeos contidos nos quilomicrons podem ter interferido nas dosagens.
As concentrações semelhantes de glicose sérica apresentadas pelos ratos controle exercitados (CE) e sedentários (C), embora concordantes com os resultados encontrados por Pereira26, Silva27, divergem dos relatos de que ocorre aumento das concentrações circulantes de repouso de glicose em ratos após 4 semanas de treinamento aeróbio de natação28. Tais discrepâncias nos resultados podem ser decorrentes de diferenças nos protocolos de treinamento entre os estudos. Uma vez mais, a administração subcutânea de lipostabil associada ao treinamento (TE) ou não (T), não teve interferência.
Uma importante alteração ocorreu no tecido adiposo subcutâneo anterior dos animais com a aplicação tópica do lipostabil: houve ligeira redução de peso desse tecido, em comparação aos controles. A redução não atingiu os níveis de significância pré-estabelecidos (p<0,05), mas aproximou-se do mesmo. Tal a redução seria um efeito esperado da aplicação tópica do medicamento4.
Outra alteração importante foi observada na concentração de glicogênio hepático e muscular: redução no grupo tratado com a droga e exercitado. Isso sugere que a aplicação tópica de fosfatidilcolina apresenta efeitos sistêmicos, se associada ao exercício. Não foram encontrados na literatura relatos de fenômenos dessa natureza, o que destaca a importância de mais avaliações, em relação aos efeitos para o organismo da aplicação tópica do medicamento.
ConclusãoResumidamente, não houve diferença entre os grupos quanto a peso e teores de gordura no tecido adiposo visceral (retroperitonial e mesentérico). Por outro lado, constatou-se ligeira redução no peso do tecido adiposo subcutâneo. As concentrações circulantes de triglicerídeos, AGL, Colesterol Total e glicose não apresentaram diferença alguma entre os grupos. Os valores de glicogênio no fígado e no músculo foram inferiores no grupo TE (tratado exercitado) comparados aos demais. O conjunto desses resultados sugere que a aplicação tópica do Lipostabil® pode apresentar efeitos sistêmicos.
AgradecimentosOs autores agradecem a C.Y. Sibuya, J.R. R da Silva e E. Custódio pelo excelente apoio técnico e ao CNPq (proc. 300270/2004-6) pelo suporte financeiro.
Referências bibliográficas
Dâmaso, A. Nutrição e exercício na prevenção de doenças. Obesidade. Rio de Janeiro (RJ): Guanabara Koogan 2001.
Sociedade Brasileira de Cardiologia. III Diretrizes Brasileiras sobre Dislipidemias e Diretriz de Prevenção de Aterosclerose do Departamento de Aterosclerose da SBC. Arq. Bras. Cardiol. 2001; 77 (3): 1-48.
Markey AC. 'Liposuction in cosmetic dermatology'. Clin Exp Dermatol 26:3. Citado em 12 nov, 2006. Disponível em: http://dx.doi.org/10.1046/j.1365-2230.2001.00748.x .
Rittes PG. The use of phosphatidylcholine for correction of lower lid buiging due to prominent fat pads. Dermatol Surg. 2001; 27 (4): 391-2.
Guyton AC. & HALL JE. Tratado de Fisiologia Médica, 10ª Ed. , Rio de Janeiro, (RJ): Guanabara Koogan; 2002
Oliveira LM. Liporeduction no quirurgica com fosfatidilcolina. In: Jornadas Mediterrâneas de Confrotaciones terapêuticas de Medicina e Cirurgia Cosméticas; Sitges, Espana. 2003; 2: 6-9.
Bobkova VI, Korsunskii VN, Tananova GV. Metabolic effect of lipostabiforte. Kardiologia 1989; 29:57.
Mel'chinskaia EN, Gromnatskii NI, Kirichenko LL. Hypolidemic effects of alisat and lipostabil in patients with diabetes mellitus. Ter Arkh. 2000; 72(8): 57-8
Donchenko V, Zannetti A, Baldini PM. Insuli-stimulated hydrolysis of phosphatidilcoline by phospholipase C and phospholipase D in cultured rat hepatocytes. Biochim Biophys. 1994; 12: 492-500.
Chung SY et al. Administration of phosphatidylcholine increases brain acetylcoline concentration and improves memory in mice with dementia. J Nutr. 1995; 125(6): 1484-9.
Takahashi Y, Mizunuma T, Kishino Y. Effects of choline deficiency and phosphatidylcholine on fat absorption in rats. J Nutr Sci Vitaminol (Tokyo). 1982; 28 (2): 139-47
Hexsel D,Serra M , Mazzuco R, Dal'Forno T, Debora Z . Phosphatidylcoline in treatment of localized fat. J Drugs Dermatol. 2003; 2(5): 511-18
Gobatto CA de Mello MA, Sibuya CY, de Azevedo JR, dos Santos LA, Kokubun E. Maximal lactate steady state in rats submitted to swimming exercise. Comp Biochem Physiol. 2001; 130: 21-7
Cinti S. The adipose organ. Prostaglandins, Leukotrienes and Essential Fatty Acids (monograph). University of Ancona, Italy, European Union, 2005.
Nogueira DM, Strufaldi B, Hirata MH, Abdalla DSP, Hirata RDC. Métodos de Bioquímica Clínica Técnica e Interpretação. São Paulo (SP): Pancast; 1990.
Dubois B, Gilles KA, Hamilton JK, Rebers PA, Smith F. Colorimetric method for determinationation of sugar and related substances. Anal Chem 1956; 28: 350-356.
Associação Brasileira para o Estudo da Obesidade e Síndrome Metabólica. Alerta quanto ao uso clandestino do Lipostabil® no Brasil. Disponível em http://www.abeso.org.br/revista/revista13/lipostabil.htm.
Gustat J, Srinivasan SR, Elkasabany A, Berenson GS. Relation of self-rated measures of physical activity to multiple risk factors of insulin resistance syndrome in young adults: the Bogalusa Heart study. J Clin Epidemiol, 2002; 55: 997-1006. (28)
Wareham NJ, Hennings SJ, Byrne CD, Hales CN, Prentice AM, Day NE. A quantitative analysis of the relationship between habitual energy expenditure, fitness and the metabolic cardiovascular syndrome. Br J Nutr. 1998; 80: 235-41
Lakka TA et al. Sedentary life style, poor cardiorespiratory fitness, and the metabolic syndrome. Med Sci Sports Exerc. 2003; 35: 1279-86.(30)
Richter EA, Turcotte L,Hespel P,Kiens B. Metabolic responses to exercise. Effects of endurance training and implications for diabetes. Diabetes Care. 1992; 15: 1767-76
American College Of Sports Medicine. ACSM stand position on the appropriate intervention strategies for weight loss and prevention of weight regain for adults. Med Sci Sports Exerc. 2001; 33: 2145-56.
American Diabetes Association. ADA stand position: physical activity/exercise and diabetes mellitus. Diabetes Care. 2003; 26: 573-7.
Bar-or O et al. Physical activity, genetic, and nutritional considerations in childhood weight management. Med Sci Sports Exerc. 1998; 30 (1): 2-10.
Durstine JL & Haskell WL. Effects of exercise on plasma lipids and lipoproteins. Exerc Sport Sci Rev. 1994; 22: 477-521
Pereira SA. Efeitos da atividade física sobre aspectos gerais e bioquímicos de ratos adultos alimentados com dieta hiperlipídica. [Trabalho de Conclusão de Curso de Graduação]. Rio Claro, SP: Universidade Estatadual Paulista Júlio de Mesquita Filho; 1992.
Silva MP. Efeitos de programas de exercício aeróbio e aneróbio sobre o perfil lipídico de ratos. [Dissertação]. Rio Claro, SP: Universidade Estadual Paulista Júlio de Mesquita Filho; 1999
Curi R. Influências do exercício físico e do jejum prolongado sobre as adaptações metabólicas ao esquema de restrição alimentar em ratos. [Tese]. Universidade de São Paulo, SP; 1984
 |
|
|---|---|
|
revista
digital · Año 13
· N° 122 | Buenos Aires,
Julio 2008 |
|