
|
|||
|---|---|---|---|
|
|
Bioenergética asociada a la actividad física y el deporte, primera parte. Generalidades sobre el metabolismo |
|
|
|
Profesor Principal de Bioquímica y Química. Escuela Internacional de Educación Física y Deporte. San José. La Habana. |
MSc. Mario Hernández Nodarse mariohn@eiefd.co.cu (Cuba) |
|
|
|
|
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 12 - N° 113 - Octubre de 2007 |
|
|
1 / 1
Introducción
La Bioquímica, es una ciencia particular que sustentada en otras como la Química, la Física y la Biología, tiene por objeto el estudio de la composición química de los organismos vivos y los fenómenos y procesos químicos-biológicos que en estos se verifican, los que garantizan la existencia, la regulación y desarrollo.
Así, dentro de su objeto aparece también todo lo relacionado al organismo humano: las estructuras, las propiedades y las funciones biológicas de las sustancias que lo forman, lo que se expresa en cientos de reacciones químicas que además de producir numerosas sustancias necesarias, traen aparejadas una transformación y obtención de la energía para la realización de múltiples actividades vitales.
Lógicamente, todo esto tiene un gran valor teórico-práctico en el contexto de la Educación Física y el Deporte. De ahí la existencia y desarrollo de la llamada Bioquímica del Ejercicio Físico o Deportiva, la que fundada por A. Hill, E. Simonson, N. N. Yakolev entre otros, está muy interesada en proteger y mejorar la salud de los individuos, así como en lograr mejores resultados, rendimiento y eficiencia de los practicantes y deportistas en general.
Una rama sobresaliente de la Bioquímica del ejercicio físico, es la Bioenergética: ciencia que se encarga de estudiar las transformaciones energéticas en los sistemas vivientes. Es decir, del estudio, adquisición y aplicación de conocimientos relacionados a los cambios de energías que se asocian a las reacciones químicas que ocurren en el organismo humano. Algo, que está regido por ciertas leyes y principios termodinámicos. De ahí, que dicha rama sea también denominada Termodinámica Bioquímica.
Es comprensible, que dicha rama científica sea imprescindible en el ámbito de la actividad física y el deporte, teniendo en cuenta que uno de los aspectos decisivos en la salud y el desempeño físico sistemático de los practicantes y atletas, radica en lograr alcanzar un eficiente aprovechamiento de los distintos sustratos energéticos que aparecen asociados a la biomasa; lo que implica convertir de forma eficaz la energía química almacenada en estos, en una energía aprovechable que se traducirá en la realización de trabajo biológico (mecánico o contráctil, por ejemplo).
La Bioquímica, y la Bioenergética en particular, resultan ser portadoras de contenidos que resultan habitualmente complejos para profesores y estudiantes de perfil deportivo. Muchas veces incluso, los que inician su estudio en carreras relacionadas a este perfil, minimizan su importancia teórico-práctica o suponen que podrían llegar a ser buenos atletas, entrenadores y profesionales de la pedagogía deportiva, sin una necesidad real de transitar por ellas. Algo, que sólo es verdaderamente superado durante su estudio progresivo y durante el desempeño práctico posterior. Todo ello, refuerza la importancia de perfeccionar y contextualizar más aún la enseñanza de las Ciencias Biológicas, a partir de una profundización científica en los contenidos temáticos.
1.1. Reflexionando algunos conceptos básicos: Energía y MetabolismoLa Energía, es una propiedad inalienable de la materia. Nos da la medida del movimiento de esta y es la capacidad de un cuerpo o sistema de realizar un trabajo. Se presenta en diferentes formas: Potencial (Ep), Cinética (Ec), mecánica, eléctrica, luminosa o radiante, eólica, hidráulica, térmica o calorífica, química, de enlace, nuclear, vibracional, rotacional, etc. Todas ellas, se agrupan en lo que llamamos "Energía Interna" (U).
En toda sustancia química (presente en la composición de nuestro organismo), existe una energía asociada en forma potencial, llamada energía química. Esta energía, se presenta fundamentalmente como energía involucrada en los enlaces químicos: fuerza que mantiene unidos a los átomos que la conforman). Recordemos también, que la materia está en constante movimiento. Esto, se cumple también a nivel atómico, pues los átomos y las moléculas vibran constantemente, oscilan, rotan, se desplazan, etc.
Una reacción química en el organismo humano, ocurre cuando las moléculas de dos o más sustancias chocan entre sí, con una orientación espacial adecuada y con la energía mínima necesaria (Energía de activación: Ea). Esto permite, la ruptura de los enlaces químicos existentes entre los átomos de las sustancias que reaccionan. Así, se forman nuevos enlaces químicos con el consecuente reordenamiento atómico. Ello, significa, un cambio de estructura y nuevas propiedades (nuevas sustancias: productos).
Pero, no sólo se forman nuevas sustancias al ocurrir una reacción química. En cada reacción, siempre habrá también una energía asociada (liberada o absorbida), la que puede calcularse por la diferencia entre las energía de los enlaces formados (liberada) y las energías de los enlaces rotos (consumida), originándose un balance energético que tiene la expresión práctica siguiente: Se absorbe energía del medio (o de otro sistema) si hay déficit (Energía absorbida mayor que la liberada) y se libera en caso contrario.
En un laboratorio, la energía absorbida o liberada por las reacciones químicas llevadas a cabo, es expresada en dos formas fundamentales: luz y calor. Por otra parte, si las sustancias que reaccionan son de naturaleza orgánica (generalmente muy complejas), entonces dichas reacciones pueden demorar varios minutos, horas, días e incluso meses. ¿Ocurre exactamente igual en el organismo humano?
En el organismo humano (en las células y tejidos), ocurren cientos de reacciones químicas simultáneamente; siempre en presencia de ciertas enzimas (son catalizadores biológicos). Una buena parte de las reacciones químicas que ocurren en el organismo humano son oxidativas, es decir, son del tipo oxidación-reducción (referido al inicio del capitulo). Estas oxidaciones-reducciones pueden ser de dos tipos fundamentales, dependiendo de las características particulares de las sustancias que reaccionan, de las condiciones de trabajo y del tipo de actividad física que se realiza:
Anaerobias: Con déficit de O2
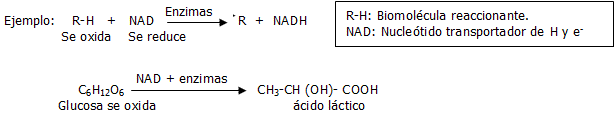
Aeróbicas: Con suficiente O2
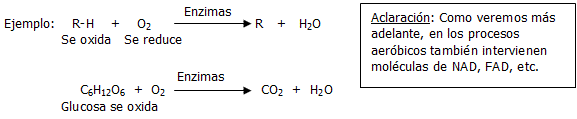
El papel regulador de las enzimas sobre los procesos bioquímicos ocurridos en el organismo humano, es particularmente destacable. Ellas, permiten que los procesos bioquímicos ocurran con una energía de activación muy pequeña (por tanto, muy rápidas) y en regimenes de temperaturas suaves (la temperatura corporal).
Las reacciones químicas que ocurren en el organismo humano, manifiestan además un principio destacable: mientras que algunas reacciones requieren del consumo de energía (endergónicas), otras liberan la energía que las primeras necesitan (exergónicas). Así, la energía se transfiere de unos sistemas (moléculas, reacciones, etc.) a otros, en un perfecto acoplamiento y armonía.
De esta manera, se puede afirmar que el organismo humano cuenta con un metabolismo: grupo o conjunto de reacciones bioquímicas que ocurren de forma acoplada y coordinada en el interior de las células (metabolismo intermediario), las que están reguladas por enzimas y hormonas, y a partir de las cuales se degradan y sintetizan sustancias de modo escalonado, valiéndose de muchos intermediarios.
El metabolismo intermediario, resulta ser el destino de los componentes dietéticos después de ser estos degradados: digeridos y absorbidos a nivel del intestino delgado principalmente. Así, todos los productos de la digestión son conducidos hacia las células de los diferentes tejidos, donde son procesados en una ruta metabólica específica. En presencia de suficiente O2, todos ellos llegan hasta un producto común: el Acetil-CoA, quien posteriormente se oxida por completo en las mitocondrias en el llamado ciclo de Krebs (o de los ácidos tricarboxílicos) hasta los productos finales del metabolismo: ATP, CO2 y H2O.
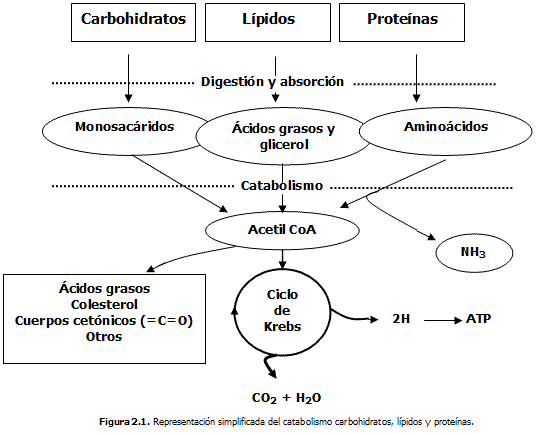
Así, un grupo numeroso de reacciones metabólicas hacen posible con la ayuda de enzimas, la oxidación y degradación de cientos de nutrientes y de sustancias complejas; tales como los carbohidratos, los lípidos y proteínas, en otras más simples: Acetil CoA (CH3-CO ~ SCoA), ácido acético (CH3 -COOH), ácido láctico (CH3 -CH (OH)- COOH), CO2, H2O, NH3, etc. Lo que se conoce como catabolismo.
Simultáneamente, otro grupo de reacciones permite biosintetizar nuevas biomoléculas que le son necesarias al organismo para la restitución de estructuras moleculares y tejidos, lo que se traduce en el mantenimiento de las diferentes funciones biológicas, el crecimiento y desarrollo del organismo. Lo que, se define como anabolismo.
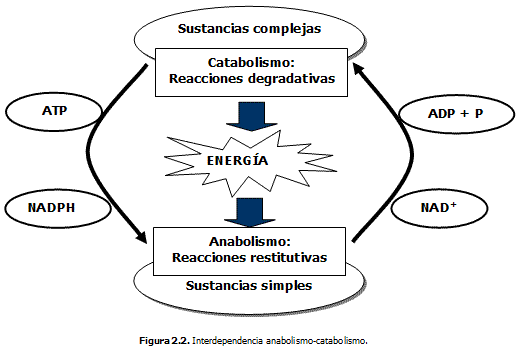
Como se aprecia en la figura 2.2, el catabolismo es la fase desasimilativa y el anabolismo es la asimilativa. Ambas fases, son contrarias y sin embargo interdependientes. En las reacciones anabólicas se absorbe y se aprovecha la energía que es liberada (transferida) por las catabólicas.
El catabolismo a su vez, puede subdividirse en tres fases:
En la fase I: las grandes moléculas nutritivas (proteínas, carbohidratos y lípidos) se degradan en sillares de construcción más sencillos.
En la fase II: Se transforman los productos obtenidos en la fase anterior en lo que se ha dado en llamar intermediarios (más sencillos), como el piruvato y el acetilCoA.
En la fase III: Los productos de la fase II resultan ser oxidados a sustancias aún más sencillas y finales (CO2, H2O y NH3).
Resumiendo lo señalado hasta aquí, podemos decir que el metabolismo tiene cuatro funciones fundamentales:
La transformación de la energía química, almacenada en las moléculas combustibles (carbohidratos, lípidos y proteínas); transfiriéndola y utilizándola de diferentes formas y con distintos fines.
La conversión de los nutrientes, en sillares de construcción (moléculas sencillas), los que son precursores de las macromoléculas celulares (más complejas).
Ensamblaje de los distintos componentes químicos para la formación de proteínas.
Formación y transformación de las distintas biomoléculas, de acuerdo a las funciones especializadas que son requeridas por las células.
Estas cuatro funciones, son de máximo interés en el ámbito de la actividad física deportiva. Especialmente la primera, pues ella implica la posibilidad de obtener, transferir y aprovechar la energía por el organismo de los atletas en el desarrollo de las actividades motrices y la ejecutoria deportiva.
La intensidad de las reacciones catabólicas y anabólicas, y el predominio de unas sobre otras, es dependiente de la edad y del tipo de actividad que sistemáticamente realiza el individuo. Así por ejemplo, se ha comprobado que en una persona joven (en franco crecimiento y desarrollo) es notable el predominio de los procesos anabólicos sobre los catabólicos. De tal manera, la velocidad de la síntesis supera la velocidad de degradación.
Esto explica, por qué en los niños y jóvenes se aprecia un aumento notable en la longitud de ciertos tejidos (óseo por ejemplo) y en el volumen de otros (muscular por ejemplo). Mientras que en la adultez, se manifiesta un cierto equilibrio entre el catabolismo y el anabolismo hasta llegar a la vejez; etapa esta en la que los procesos degradativos superan en tendencia y velocidad a los de síntesis.
Es fácil comprender también, que el organismo de los sujetos que practican actividad física sistemáticamente, se ve sometido constantemente a un nivel de excitación nerviosa elevado, a un entrenamiento en el que los volúmenes, la intensidad y las cargas de los ejercicios físicos son muy superiores a los que enfrenta una persona común y corriente.
Al desarrollar un trabajo muscular sistemático, los procesos metabólicos se incrementan en cantidad, en intensidad y en velocidad. Ello, equivale a un incremento de las reacciones y de los cambios bioquímicos no sólo en el tejido muscular esquelético, sino también en la sangre y en la orina.
Es necesario comprender, que durante una actividad física desarrollada por un atleta, el organismo no pone en funcionamiento sus diferentes órganos de manera aislada; sino que lo hace en plena armonía e interdependencia. Así, el sistema endocrino por ejemplo, bajo el control del sistema nervioso central, incrementa la secretación de distintas hormonas (adrenalina, noradrenalina, ADH, aldosterona, cortisol, glucagón y otras) que tendrán que regular y favorecer múltiples procesos bioquímicos y fisiológicos (la permeabilidad de membranas, la actividad enzimática, la ocurrencia de determinadas reacciones químicas, etc.).
Simultáneamente, es incrementada la frecuencia de sístoles (contracciones cardiacas), permitiendo así que la sangre sea bombeada a una mayor intensidad, para poder distribuir las sustancias necesarias hacia todos los órganos, tejidos y células del cuerpo; donde serán metabolizadas en correspondencia con las mayores exigencias que establece el propio metabolismo del atleta.
En estas condiciones de trabajo físico, los procesos anabólicos se frenan prácticamente, porque la energía que estos requieren para ocurrir (acumulada en el ATP como veremos más adelante) está siendo invertida casi totalmente en la excitación, en la degradación (oxidación) de los sustratos energéticos (glucógeno, CrP, glucosa-6-P, etc.), en el transporte de sustancias a través de membranas, en el trabajo contráctil y en otros procesos biológicos.
Esto lógicamente, representa un nivel de, debiéndose cuidar y velar por lograr un abastecimiento de energía y la restitución de tejidos necesarios, ocurridos previo y posterior a los entrenamientos.
Ahora cabe preguntarse: ¿cómo ocurren concretamente las transformaciones de energía en el organismo humano? ¿Qué principios y leyes las rigen?
1.2. Las transformaciones de energía durante el metabolismo. La energía libre (ΔG) como energía útil asociada a un sistema. Primero y segundo Principios de la TermodinámicaEl organismo humano es un sistema abierto, puesto que intercambia materia y energía con el medio exterior. Entendiendo como sistema, aquella parte del universo que aislamos para su estudio; lo que generalmente está determinado por el interés particular de quien realiza dicho estudio, o por las características físicas y/o funcionales de dicha parte.
De este modo, es comprensible que partiendo del campo de estudio de la Bioquímica como ciencia, consideremos también como sistema a una sustancia, un grupo de ellas o a una reacción en particular. Cada uno de ellos, siempre intercambia con otro (considerado alrededores) la energía en sus diferentes formas. Así, la energía es transferida de un cuerpo, sustancia o reacción química (de mayor energía) a otros de distintas maneras. Esto se traducirá por ejemplo, en un aumento de la Energía Interna (U) de unos a cambio de la disminución de la U de otros, conservándose así la energía total del universo (Ley de conservación de la energía: 1er Principio de la Termodinámica)
La energía interna (U), puede intercambiarse o transferirse de un cuerpo (sistema o sustancia) a otro a través de dos maneras fundamentales (I y II):
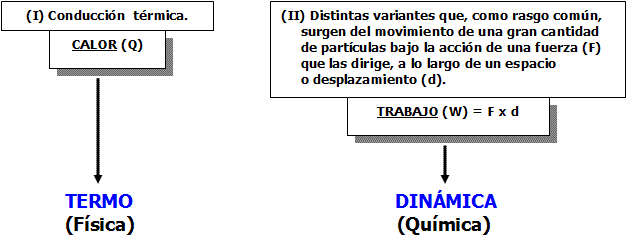
La fuerza (F), desde el punto de vista físico, es la acción capaz de modificar el estado de reposo (o de movimiento) de un cuerpo. Pero a su vez, es una capacidad física (motriz) que se presenta o que se ve favorecida por los músculos durante el trabajo muscular.
En el sistema internacional de unidades, la fuerza se mide en Newton (N): 1 N es la fuerza que proporciona a un objeto de 1 Kg. de masa una aceleración de 1 m/ S2 (Kg. m. S-2). Mientras que el desplazamiento o distancia (d), es el espacio recorrido por el cuerpo, pudiendo reflejarse en metros (m).
El trabajo (W), como forma de energía (en tránsito) se expresa en joule (J). Cada J es equivalente a 1 N.m.. De esta manera, el trabajo mecánico realizado por un corredor de 70 kg. a lo largo de 100 m planos durante 10 segundos (s) de carrera es igual a: 70 000 J
La relación existente entre el calor (Q) y el trabajo (W), es manifestada continuamente en los procesos naturales (medios ambientales, biológicos, etc.). Se trata, de la relación existente entre la forma física de los cuerpos o sustancias y la transformación dinámica que estos experimentan en su movimiento continuo e interacciones (condición indispensable para que ocurra una reacción química).
Esta relación natural entre lo físico, lo químico y lo biológico, explica la relación existente entre las distintas ciencias y disciplinas que se ocupan del estudio de los fenómenos naturales. Desde esta relación, se erige la Termodinámica, más que como rama aislada, como tronco y fundamento científico de la Bioquímica del ejercicio físico, estableciendo distintas leyes y principios que rigen dichos fenómenos, ocupándose de manera especial del estudio de las transformaciones de energía que ocurren en el organismo humano: Bioenergética.
Entonces queda claro, que la termodinámica representa el campo de las ciencias físicas-químicas que estudia los cambios (intercambios) de energía, ocurridos al pasar un sistema (conjunto de sustancias y energías que representa un foco de estudio) de un estado inicial a otro final.
Al estudiar un sistema, este se debe aislar para que, bajo ciertas condiciones (estado del sistema) pueda ser valorado cómo ocurren las transformaciones químicas y cómo es llevada a cabo la transferencia de energía de un estado inicial, reacción, cuerpo o sustancia (con una energía interna U1) a otros (con energía interna U2).

Se deduce de lo anterior, que la energía de un sistema se puede incrementar durante una reacción química, a través de 2 vías o formas: Absorbiendo energía calorífica (+Q) y/o recibiendo un trabajo útil (-W).

De esta manera, la energía interna (U) de un sistema siempre será la misma. Es decir, ella no se crea ni se destruye, sólo se transforma.
Significa lo anterior, que los organismos vivos no pueden crear energía, solamente transferir la energía química inicialmente y potencialmente contenida en los alimentos (en forma de glucógeno, glucosa, grasa y proteínas) a determinados sustratos más viables y convenientes (CrP, ATP, etc.), los que la acumulan para ser transformada después en calor (muy poco) y trabajo (W) esencialmente.
La energía contenida dentro de las estructuras químicas de los carbohidratos, las grasas y las proteínas no se libera en el cuerpo de manera repentina a una temperatura incendiaria; sino más bien lentamente y en pequeñas cantidades durante reacciones químicas ocurridas en el organismo.
En un laboratorio, la energía liberada al oxidarse (combustionar) la glucosa (ejemplo 1) es básicamente calorífica. Esta misma reacción se verifica en el organismo humano, siendo esencial dentro del metabolismo de los carbohidratos. Sin embargo, aquí tiene que ocurrir a temperatura y presión notablemente bajas y aproximadamente constantes (condiciones corporales). Por tanto, dicha energía tiene que ser básicamente transformada, no en forma de calor como pudiera ocurrir en el laboratorio, sino en forma de energía libre (ΔG), siendo así aprovechable para la realización de un trabajo biológico determinado (W), lo que es posible gracias a la presencia e intervención de enzimas, las que como vimos en el Cap. I, minimizan las pérdidas de energía (calor por ejemplo) posibilitando que las reacciones químicas ocurran a gran velocidad con un costo energético bajo (Ea) y a temperaturas suaves.
Ejemplo 1: Oxidación de la glucosa.

Es decir, la energía libre (ΔG) es la forma útil en que los sistemas químicos presentes en el organismo (a nivel celular) toman y transfieren la energía; pudiendo definirse simplemente esta, como aquella energía que es capaz de realizar trabajo (W) a la temperatura y presión corporal (constantes).
Entonces, si como indica el ejemplo anterior, el ΔG asociado a un proceso o reacción química tiene un valor negativo (ΔG< 0), debemos interpretar termodinámicamente que:
La reacción es espontánea.
La reacción es exergónica (libera energía)
Genera una energía aprovechable (energía libre).
Es capaz de propiciar la realización de un tipo de trabajo determinado.
La energía en el organismo humano, es entonces clasificada y transferida de dos formas básicas, las que podemos subdividir y relacionar como se indica a continuación:
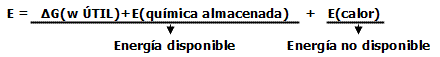
La energía almacenada, es una energía potencial almacenada en ciertas biomoléculas tales como CrP, ATP, ADP, fosfoenol piruvato, etc.
El organismo humano (las células en particular), se ve obligado a devolver al entorno aquella energía que le resulta menos útil: generalmente la calorífica (Q) y otras formas poco utilizables, las que rápidamente se distribuyen al azar en el medio exterior.
Igualmente, es importante saber que toda reacción química espontánea (ΔG< 0), lleva implícito la tendencia a liberar energía calorífica a presión constante (ΔH ) y la tendencia a un máximo desorden o libertad (ΔS). En otras palabras, el balance entre ambas tendencias, determinará la espontaneidad o no de una reacción.

Toda reacción espontánea (ΔG <0), evoluciona hacia un estado de equilibrio (K), y sólo abandona dicho estado por la acción de una fuerza externa (W).

Si embargo, debemos precisar dos términos ΔG y ΔG0. Realmente al alcanzarse el estado de equilibrio el ΔG del sistema es cero (el sistema no es capaz de efectuar trabajo). Mientras que ΔG0 (variación de energía libre estándar), expresa cuanto disminuye la energía libre del sistema cuando este evoluciona hacia un estado de equilibrio (condiciones en que teóricamente el sistema es capaz de realizar trabajo). De ahí que, ΔG0 y K puedan quedar relacionados como se indica:

A la temperatura corporal (constante), muchas reacciones o sistemas del organismo humano pueden alcanzar un estado de equilibrio químico, el que debido a que las velocidades de los procesos directo e inverso de la reacción se igualan (lo que supone reversibilidad), logra alcanzar una relación constante entre las concentraciones y/o presiones de productos y reaccionantes (cociente de reacción). Esta relación invariable a dicha temperatura entre productos y reaccionantes, se conoce como constante de equilibrio (K). Estado de equilibrio, que puede ser modificado (o perdido) si son modificados ciertos parámetros del sistema (concentraciones de sustancias, presiones parciales, temperatura, etc.) bajo fuerzas externas.
Ejemplos de reacciones espontáneas, reversibles y en equilibrio.
Resíntesis de ATP en condiciones anaerobias a partir de la fosfocreatina (CrP). Vía fosfagénica).
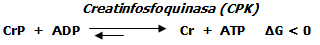
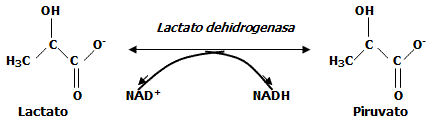
Reducción del piruvato en lactato (Glucólisis láctica).
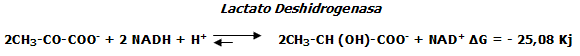
Precisamente, es la glucólisis un proceso metabólico plurienzimático en el que se disipa (se pierde) una cantidad notable de energía en forma de calor; lo que se manifiesta en un sobrecalentamiento muscular que atenta contra la eficacia del proceso de resíntesis de ATP en las condiciones anaerobias lactácidas.
1.3 Fosfatos de alta energía. El ATP. Particularidades y papel en el metabolismoEsta energía química, es almacenada y transferida como ya se señaló, por determinadas biomoléculas, esencialmente por el adenosintrifosfato: ATP; lo que permite la realización de múltiples trabajos biológicos (la excitación nerviosa, la síntesis y transporte de sustancias, contracción y la relajación muscular, etc.)
Ya sabemos, que entre los procesos catabólicos (exergónicos) y anabólicos (endergónicos) existe una interdependencia, centrada en el intercambio y en la transferencia de energía. Se presentan entonces, nuevas interrogantes al respecto: ¿Cómo está mediada la transferencia de energía entre unos procesos y otros? ¿Qué cualidades estructurales posee el ATP y otras biomoléculas, que les permiten actuar como portadoras de energía y como mediadoras en dichas transferencias?
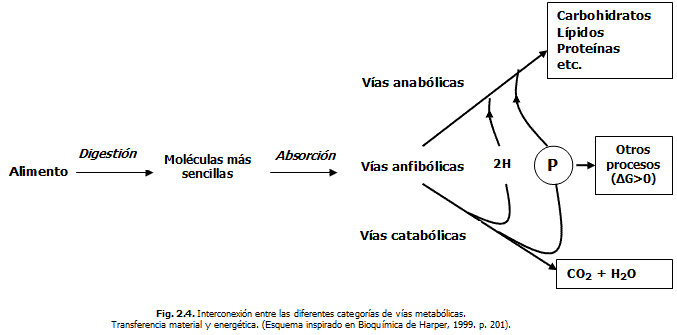
Según muestra la figura 2.4., es evidente que los equivalentes reductores (2H) son transferidos de las sustancias que se oxidan (en los procesos catabólicos) a las que se reducen (en los procesos anabólicos). La transferencia de átomos de hidrógeno (H) involucra a su vez la transferencia de electrones (e-); cuestión abordada cuando reflejamos al inicio de este capitulo el concepto de reacciones REDOX. Esta transferencia de H en los procesos bioquímicos del metabolismo humano es bien complicada y es propiciada por la intervención de ciertas coenzimas (NAD, FAD, etc.), las que actuando como "segundos sustratos" (estudiado en el capitulo I), complementan la actividad catalítica de las enzimas transportando H.
Algo parecido ocurre, con los grupos fosfatos de naturaleza inorgánica (PO32-) que están presentes en ciertas biomoléculas, las cuales son llamadas habitualmente "fosfatos de alta energía". Ambos grupos de átomos, constituyen formas materiales (partículas) a través de las cuales, se propicia la transferencia de la energía de los procesos exergónicos a los endergónicos.
La incorporación de grupos fosfatos mediante reacciones químicas a ciertas moléculas orgánicas, es uno de los aspectos más relevantes del metabolismo, pues muchas biomoléculas sólo pueden ser metabolizadas en caso de estar fosforiladas. Consecuentemente, existen donantes y aceptores de grupos fosfatos (PO32-).
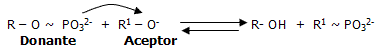
Algunos ejemplos de biomoléculas del tipo R-O~PO32-, llamados "fosfatos de alta energía":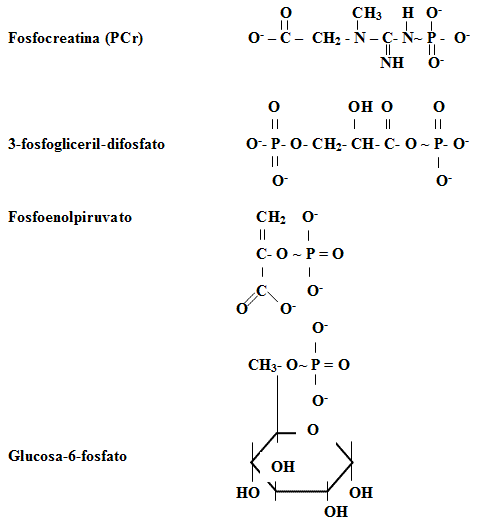
Realmente, el término "fosfato de alta energía" está determinado por la presencia en estas biomoléculas de uno o varios grupos fosfatos (PO32-), particularmente por los "enlaces macro energéticos" asociados (término introducido por Lipmann) e indicados en las formulas químicas anteriores (~).
La tabla II-1, muestra algunos datos que permiten reflexionar en torno a ciertas propiedades de algunos de los enlaces químicos presentes comúnmente en muchas biomoléculas:
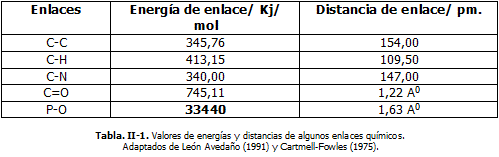
Los átomos al unirse entre sí (enlazarse) lo hacen con una fuerza y una energía asociada (de enlace); lo que determina a su vez una cierta distancia de enlace (d). Influye en ello, el tamaño de los átomos enlazados, la electronegatividad, la cantidad de enlaces interatómicos (orden de enlace). Así por ejemplo, siendo los átomos pequeños y estando unidos mediante enlaces múltiples, la unión es más fuerte (más estable) y se originan vibraciones más intensas (semejante a dos esferas unidas entre sí por un muelle).
Como puede observarse, la energía de enlace P-O es notablemente menor y lógicamente la distancia del mismo, es notablemente mayor que la de otros enlaces presentes en las biomoléculas. Esto hace preguntarnos: ¿Entonces por qué este es llamado "enlace de alta energía"?
Realmente, el término (bioquímico) está asociado más bien a la facilidad con que es roto el enlace P-O durante la hidrólisis y es transferida así la energía a él asociada, hacia otros procesos y sistemas, y no el contenido energético propiamente dicho de estos enlaces (como hacen tradicionalmente los químicos y físicos) como usualmente se piensa, cosa que puede constatarse en la tabla II-1.
En realidad los enlaces covalentes presentes en las biomoléculas son muy estables, lo que supone gran cantidad de energía absorbida para su ruptura. Por lo que específicamente, debemos entender que el término "enlaces de alta energía" está referido a la diferencia entre la energía libre de los productos y la energía libre de los reaccionantes manifestada durante la hidrólisis (ruptura frente al agua). Cuestión que puede comprenderse al analizar la tabla II-2, en la que se infiere la facilidad relativa con que son rotos dichos enlaces y la estabilidad termodinámica de estas sustancias.
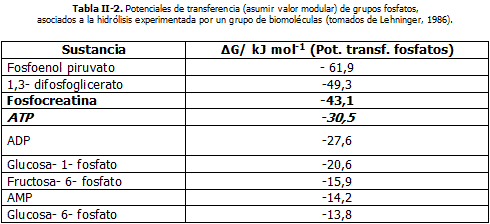
Es oportuno saber, que existen otras biomoléculas como el acetilCoA, quien además de ser un donante importante de grupos acetilos en los procesos oxidativos aeróbicos ocurridos en las mitocondrias, posee un enlace sulfuro C~ S rico en energía (10 Kcal/ mol = 418 Kj/mol). Cuestión que, como veremos posteriormente en este capitulo, son aprovechadas durante el metabolismo de los carbohidratos, lípidos y proteínas.
Ciertamente, todas las biomolélulas referidas tienen un papel importante dentro del metabolismo. Y podría pensarse que, a mayor potencial de transferencia de grupos fosfatos mayor es la importancia metabólica. Pero, como podrá comprenderse progresivamente, no es así. Ninguna de ellas juega un rol tan decisivo en los procesos biológicos y en la práctica de la actividad física sistemática como el Adenosintrifosfato (ATP). Un análisis de su estructura, permitirá argumentar esto seguidamente.
Estructura del Adenosintrifosfato (ATP)
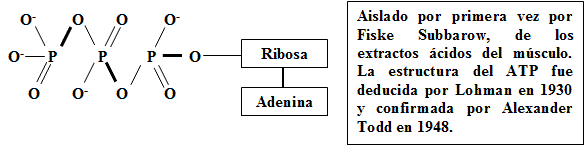
Características estructurales del ATP:
Biomolécula (nucleótido) en la que se combinan: 1 molécula del carbohidrato ribosa, la base nitrogenada adenina y 3 grupos fosfatos (PO32-).
Cada grupo fosfato conforma un conglomerado atómico de forma tetraédrica (tres tetraedros unidos entre sí). Conformando una estructura parcial P3O104-.
Cada átomo de fósforo (P) presente en la molécula, está rodeado de cuatro grupos de electrones. Lo que implica una hibridación sp3 y una geometría tetraédrica del P.
Todos los enlaces químicos son covalentes. Los P-O son de tipo δ, mientras que los P=O (dobles) están constituidos por un δ y otro ? (más débil y móvil). No obstante, todos los enlaces terminales P-O son aproximadamente equivalentes por ser resonantes (deslocalización de los electrones ?). HO-P-OH con ángulos de aproximadamente 105-1070, mientras que HO-P-O son de 110-1120 (Heslop-Robinson, 1962; Cartmell-Fowles, 1975).
Los "enlaces de alta energía" (P-O) que unen entre sí a los grupos fosfatos, son susceptibles a producir hidrólisis (abordada más adelante).
Los grupos OH presentes son particularmente polares, debido a la alta polaridad del enlace covalente existente entre estos átomos. Esto determina, que dicho enlace experimente una ruptura no uniforme (heterolísis), originándose la salida del H en forma de protón (H+) y quedando una carga negativa sobre el átomo de O (-O-).
Propiedades destacables del ATP derivadas de su estructura
Solubilidad en medio acuoso
La presencia de grupos de alta polaridad (-OH, -PO, etc.) en el ATP, su susceptibilidad a la hidrólisis y su fuerte tendencia a formar aniones (partículas cargadas negativamente), permite que esta biomolécula pueda encontrarse "a gusto" en el medio acuoso existente en el citoplasma, mitocondrias y otros orgánulos celulares; lo que propicia su intervención en los procesos asociados al metabolismo intermediario esencialmente.
Carácter acídico del H hidroxílico
A la luz de la teoría ácido base de Browted-Lowry, la notable polaridad del grupo -OH ya referida propicia que el ATP no aparezca realmente en el organismo en forma molecular, sino en forma iónica (ATP4-, ATP3- y ATP2-). Estas formas activas, se asocian a cationes metálicos como: Mg2+, Ca2+, abundantes en el citoplasma y en orgánulos celulares como mitocondrias y núcleos (Ej. células del tejido muscular) y también a moléculas proteicas como la actina y la miosina; formando estructuras complejas (MgATP2-, CaATP2-) que son fundamentales en la contracción muscular, en la función enzimática ATPásica y otros procesos metabólicos.
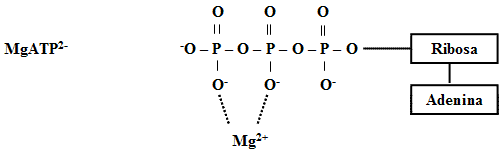
La elevada concentración de cargas negativas asociadas a los átomos de oxígeno y el fenómeno de resonancia, que como se refiere anteriormente experimenta la molécula, son precisamente factores estructurales decisivos en la función de transferencia de energía del ATP. Por su importancia en la comprensión de sus propiedades, daremos algunos argumentos relativos a estos factores.
Como puede apreciarse, en la estructura del ATP existen tres grupos fosfatos los que en total acumulan tres dobles enlaces (P=O) y 4 átomos de O cargados negativamente situados muy próximos unos de otros. Todo esto origina fuertes tensiones (repulsiones eléctricas) que son eliminadas o disminuidas al hidrolizarse (romperse) los enlaces interfosfatos; lo que evidentemente es una tendencia muy favorable para estabilizar a la molécula; razón por la cual dicha hidrólisis y transferencia correspondiente de los grupos fosfatos resulta ser un proceso muy espontáneo.
Todos los compuestos fosforilados (contienen grupos fosfatos) son híbridos de resonancia (consultar León Avedaño, 1991; Cartmell-Fowles, 1975 u otras fuentes), los que se estabilizan más o menos dependiendo de las diferentes energías de resonancia asociadas a cada molécula, lo que depende a su vez de la estructura electrónica de la estructura molecular en particular. De ahí que, por ejemplo, la tendencia a la hidrólisis del ATP es más fuerte que en la glucosa-6-fosfato (Tabla II-2: ver potenciales de transferencia de grupos fosfatos).
Hidrólisis del ATP
Producto de las interacciones y los choques efectivos ocurridos entre el ATP y las moléculas de agua (H2O) bajo la acción enzimática, los tres enlaces P~O de "alta energía" del primero y uno de los enlaces O-H del agua se rompen, con el consecuente reordenamiento atómico que origina la formación de nuevos enlaces y nuevas estructuras moleculares (ADP, AMP y P (H3PO4) ) y la liberación de una energía libre aprovechable (proceso exergónico) para la realización de distintos tipos de trabajo biológico: de transporte activo de sustancia a través de membranas, para la contracción y la relajación muscular, en el impulso nervioso, en la secretación hormonal, para la realización de múltiples reacciones del metabolismo (endergónicas) en la que se formas cientos de sustancias necesarias al organismo, etc.
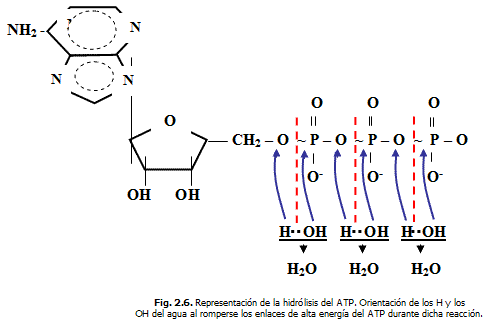
Comparemos a continuación las ΔG de hidrólisis del ATP, ADP y AMP.
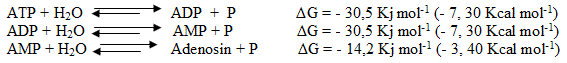
Note en primer lugar, que la diferencia de la ΔG asociada a la hidrólisis de los diferentes nucleótidos no es igual. ¿Por qué ocurre esto? Los enlaces entre los grupos fosfatos terminales del ATP y ADP son anhidros, mientras que el enlace entre el grupo fosfato y la ribosa del AMP es tipo éster (menos energético), siendo diferentes por tanto sus potenciales de transferencia (indicado en la tabla II-2.).
También es importante destacar, que en la energía libre de hidrólisis (ΔG) pueden influir un grupo de factores, como el pH y las concentraciones existentes de Mg2+ en las partes ya indicadas de las células musculares. Se ha podido comprobar (Lehninger, 1986. p.412), que el ΔGATP experimenta un incremento acentuado al incrementarse el pH (disminución de la c(H+) del medio); lo que deja claro, que cuando se realiza una actividad física intensa en la que los niveles de lactato e H+ no son regulados; la disponibilidad de transferencia de grupos fosfatos y energía aportada por el ATP puede ser bloqueada.
Es necesario apuntar que, la disminución de iones Mg2+ de 50 a 10 mM afecta también la capacidad de hidrólisis del ATP. Téngase en cuenta, que la afinidad de los Mg2+ por el ATP crece en la medida que el pH crece. De hecho, incluso la propia hidrólisis del ATP disminuye el pH celular.
En tercer lugar, debe quedar claro que el ATP coexiste junto al ADP y al AMP en un equilibrio que estará más desplazado en un sentido u otro (proceso reversible), de acuerdo a los requerimientos metabólicos, conformando así un "sistema" de transferencia energética muy importante en el desempeño físico de los deportistas.
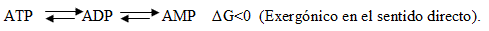
La degradación y la resíntesis del ATP (endergónico) de acuerdo al sistema indicado, ocurren a gran velocidad en correspondencia con los pocos segundos de actividad que pueden ser abastecidos con las reducidas reservas ATP/ADP/AMP existentes, en relación con las continuas demandas en los tejidos activos. Tan importante es dicho sistema y las correlaciones establecidas entre las concentraciones de ATP, ADP y AMP que coexisten en el organismo humano, que la disponibilidad y la "carga energética" existente en un momento dado, es calculado a partir de la ecuación siguiente:
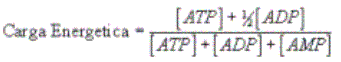
Debe comprenderse que, una carga energética alta, significa una disponibilidad suficiente de ATP, por lo que el catabolismo estará inhibido y el anabolismo activado. Si la carga energética es baja, es señal de que falta ATP, por lo que el anabolismo estará inhibido y el catabolismo activado. Quedando claro, que en las células siempre se cumple: c(ATP) + c(ADP) + c(AMP) es constante.
A todo lo señalado relativo a la hidrólisis del ATP, debemos añadir que es precisamente esta propiedad uno de los argumentos termodinámicos más fuertes que hacen que dicha biomolécula sea considerada como la piedra angular del metabolismo. Si retomamos la tabla II-2, podemos apreciar la posición estratégica intermedia del adenosintrifosfato de acuerdo al valor de su ΔGhidrólisis. Esto llamó poderosamente la atención de los científicos, cuando alrededor de 1940 se realizaron los primeros estudios y experimentos relacionados con los detalles bioquímicos de procesos como la glucólisis, la metabolización de la fosfocreatina y la degradación y resíntesis del ATP durante la contracción muscular y los procesos oxidativos ocurridos en el músculo durante la actividad física.
Esta posición intermedia, expresa la capacidad del ATP de actuar como donador de grupos fosfatos del "alta energía" para formar compuestos colocados por debajo de él en dicha tabla. De igual manera, estos pueden aceptar grupos fosfatos para formar ATP y otras biomoléculas colocadas por encima de él en dicha relación (más inestables termodinámicamente), siempre que se pueda disponer de los sistemas enzimáticos necesarios para ello. En otras palabras, el ATP se comporta como una especie de "moneda de cambio" energético dentro del metabolismo.
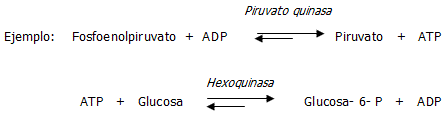
Como estudiaremos más adelante, existen tres procesos principales comprometidos en la conservación, captura y transferencia de los grupos fosfatos (energía):
Mantenimiento de los niveles necesarios de ATP a nivel muscular con déficit de O2, a partir de la fosfocreatina (PCr)
La glucólisis.
El ciclo de Krebs (o del ácido cítrico) ocurrido en mitocondrias.
La fosforilación oxidativa.
Funciones del ATP
Aporta la energía (química) que necesitan las múltiples reacciones químicas que ocurren en el organismo: Procesos oxidativos de sustancias combustibles como el glucógeno, la glucosa y los lípidos.
Aporta la energía necesaria para la ocurrencia de casi todos los procesos celulares: Respiración, secreción hormonal, biosíntesis de sustancias (reparación de tejidos), transmisión de impulsos nerviosos, división celular, etc.
Aporta la energía necesaria para el transporte de sustancias a través de membranas (30 % del ATP).
Facilita la energía necesaria para la contracción muscular. El ATP es fuente inmediata de energía para el trabajo muscular.
Su forma aniónica, juega es decisiva en el mecanismo de contracción muscular.
Tiene actividad enzimática (ATPásica), facilitando la ocurrencia de muchas reacciones bioquímicas del organismo a la velocidad necesaria.
Resumen
El organismo humano, logra convertir la energía que se encuentra almacenada en distintos sustratos energéticos en otras formas más útiles de energía (ΔG), aprovechándolas en el desarrollo de sus funciones vitales y en actividades físicas sistemáticas, en franca interrelación con el medio ambiente.
Por otra parte, es evidente que las biomoléculas encargadas de almacenar la energía química que es incorporada al organismo a través de los alimentos, desempeñan un por el rol protagónico esencial dentro del metabólico. Lo que, apunta a la necesidad de estudiar las características estructurales, las propiedades y las funciones particulares que tienen dichas moléculas; en especial el ATP.
El metabolismo manifiesta la ocurrencia de muchas reacciones enzimáticas simultáneas, aseguradas y acopladas entre sí mediante un intercambio de materia (-R, H, O, PO32-, etc.) y energía (libre: ΔG y trabajo: W) centradas en la transformación de la energía química almacenada en los enlaces macroenergéticos presentes en ciertas biomoléculas. La mayoría de estas reacciones lleva consigo frecuentemente la formación y utilización de adenosintrifosfato (ATP) aprovechando sus "enlaces de alta energía" y la susceptibilidad de estos ante la hidrólisis.
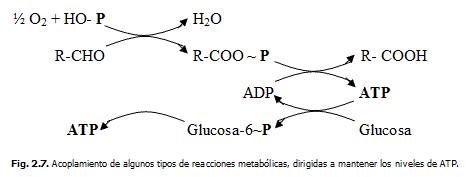
El ATP almacena, transporta y sirve de puente material y energético durante el metabolismo humano.
La cantidad de ATP almacenada en el músculo es apenas 5 u 8 mmol/ Kg de la masa muscular (en fibras blancas es ligeramente inferior) y en el interior de las células de 5 x 10-6 mol/g, lo que sólo posibilita la actividad muscular mantenida durante unos pocos segundos. De ahí, la importancia que tiene para el organismo la resíntesis de ATP.
Bibliografía
Acevedo del Monte, R (1987): Química Física. Editorial Pueblo y Educación. Ciudad Habana. Cuba.
Haurowitz, F. (1967): Introducción a la Bioquímica. Editorial Revolucionaria. La Habana. Cuba.
Heslop, R. B and Robinson, P. L (1970): Química Inorgánica. Editorial Alambra, S. A, Madrid-México.
Lehninger, A (1986): Bioquímica. Editorial Revolucionaria. La Habana. Cuba.
León Avedaño, R (1991): Química General. Editorial Pueblo y Educación, Ciudad de La Habana. Cuba.
León Oquendo, M (2004): Bioquímica. Bases para la actividad física. Editorial Deportes. Ciudad de la Habana. Cuba.
Menshikov, V. V y Volkov, N. I (1990): Bioquímica. Vneshtorgizdat. Moscú.
Murria, R. K; Granner, D. K; y otros (2001) Bioquímica de Harper. Editorial El Manual Moderno.México, DF. Santa Fé de Bogotá.
 |
|
|---|---|
|
revista
digital · Año 12
· N° 113 | Buenos Aires,
Octubre 2007 |
|