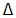|
|||
|---|---|---|---|
|
|
Biogénesis mitocondrial en músculo esquelético inducida por actividad contráctil |
|
|
|
*Autor. Universidad del Estado de Nueva York. Profesor de Kinesiología y Ciencia de la Salud, y Biología. (Canadá) **Traductor. Profesor de Educación Física. Magíster en Fisiología del Ejercicio. (Chile) |
PhD. David A. Hood* dhood@yorku.ca MSc. Rodrigo Ramirez Campillo** ramirezcampillo@hotmail.com |
|
|
|
Traducción del artículo Hood, David A. Invited Rewiev: Contractile activity-induced mitochondrial biogenesis in skeletal muscle. J Appl Physiol 90: 1137-1157, 2001.
|
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 12 - N° 112 - Septiembre de 2007 |
|
|
1 / 1
Introducción
Debido al hecho que las mitocondrias son una fuente importante de ATP celular, no deberíamos sorprendernos al aprender que el número de estas por célula, así como también su ubicación intracelular, varía en dependencia del tipo de célula y de acuerdo a su estado metabólico.
Solo hace pocos años pudo ser demostrado que el tamaño mitocondrial, su número y/o volumen puede incrementarse en un determinado tejido (como en el músculo esquelético) es respuesta a un estímulo fisiológico (como el entrenamiento de endurance). Este descubrimiento es importante para los fisiólogos del ejercicio interesados en el entendimiento de las bases celulares del rendimiento de endurance y es de importancia práctica para los atletas involucrados en planes de entrenamiento. Además, la relevancia clínica también debe ser considerada en forma importante, debido a que el contenido mitocondrial puede ser reducido drásticamente durante periodos prolongados de desuso muscular, como durante la inmovilización de un miembro o denervación muscular. El amplio impacto que tienen los cambios en el contenido mitocondrial de un determinado tejido para otros campos de la biología celular no era tan aparente como lo es hoy. Discusiones sobre la función mitocondrial, expresión genética y síntesis, son hoy tema regular en los laboratorios de biología celular. El término "biogénesis mitocondrial", que implica los procesos celulares involucrados en la síntesis y degradación del organelo, es hoy utilizado con mayor regularidad y aparente relevancia. La mitocondria es ahora reconocida no solo como la "fábrica energética de la célula", por lo cual es famosa, si no que además hoy se le conoce por su importancia en la patogénesis de enfermedades con amplia relevancia clínica.
Nuestro entendimiento del funcionamiento mitocondrial ha progresado rápidamente en los últimos años debido a varias razones. Primero, debido a los avances de la biología molecular, con técnicas como el ADN recombinante, análisis cuantitativo de DNA y ARNm, el uso de modelos animales y de células en cultura y la tecnología de transferencia de genes, factores que han permitido investigar en profundidad los eventos celulares y moleculares involucrados con el funcionamiento mitocondrial. Estas técnicas se complementan con los avances en la microscopia electrónica, que ha permitido tener una mayor resolución de la estructura del organelo y que, al combinarse con tecnología de detección fluorescente, permite la medición del movimiento de iones en varios compartimientos de la célula viva. El resultado de estos avances tecnológicos es que ahora podemos apreciar nuevos roles para la mitocondria, ya no solo como el principal organelo encargado de proveer ATP, sino que además como un mediador de eventos apoptoticos que lleva a la muerte celular, como un organelo que posee un genoma separado y semi autónomo (mtDNA) y como un sitio celular donde tienen lugar eventos de transducción de señal, que pueden ayudar a coordinar la expresión genética nuclear y mitocondrial.
La biogénesis mitocondrial puede ser un evento dramático, particularmente cuando es invocada en un músculo esquelético blanco, poco oxidativo. En respuesta al ejercicio, la conversión del fenotipo del músculo blanco a uno con una apariencia visiblemente roja es posible por la síntesis adicional de grupos heme y su incorporación a los citocromos mitocondriales, así como también se incorporan a la mioglobina. El gran incremento de contenido mitocondrial puede tener un profundo impacto en el metabolismo celular durante el estrés del ejercicio. Esta revisión se centra en tópicos actuales sobre biogénesis mitocondrial, con énfasis en el músculo esquelético y el rol de la actividad contráctil (como por ejemplo, el ejercicio).
Lo fundamental sobre la biogenesis mitocondrial muscularLa biogénesis mitocondrial puede ser producida por varias condiciones fisiológicas
El entrenamiento de endurance, al emplear una apropiada duración por día, una frecuencia por semana y una intensidad submáxima pro sesión de ejercicio, puede producir un incremento en el contenido mitocondrial, usualmente en el rango de 50 a 100% dentrote un periodo de 6 semanas. Esto tiene como resultado un incremento en el rendimiento de endurance, en gran medida independiente de los relativamente pequeños incrementos en consumo de oxígeno submáximo. La biogénesis mitocondrial puede ser inducida por varias formas artificiales de ejercitación, como la actividad contráctil crónica producida por electro estimulación del nervio motor. Este modelo tiene la ventaje de producir un cambio relativamente mayor en el contenido mitocondrial en un periodo más corto de tiempo (1 a 3 semanas). El tratamiento con hormona tiroidea también puede resultar en un incremento de biogénesis mitocondrial. Esto representa un estímulo muy diferente, actuando vía receptores nucleares y mitocondriales, que en definitiva llevará a producir un mayor contenido mitocondrial. La respuesta de los músculos a la hormona será específica dependiendo del tipo de fibra, lo cual se debería a diferencias en la distribución de receptores para la hormona. Las vías independientes de acción sobre la biogénesis mitocondrial de la actividad contráctil y de la hormona tiroidea son evidentes a partir de modelos experimentales practicados en animales tiroidectomisados y sometidos a actividad contráctil crónica. Sin embargo, ambas condiciones parecen resultar en una incrementada masa mitocondrial funcional, dando una mayor capacidad para el consumo de oxígeno por grama de tejido.
El contenido mitocondrial tiene una vida media corta y el fenotipo mitocondrial puede cambiarEl contenido mitocondrial puede ser medido directamente, utilizando estimaciones morfométricas del volumen del organelo en relación al volumen celular total. Pero más comúnmente, se estima a partir del cambio en la actividad máxima de un marcador enzimático (la actividad se mide bajo condiciones optimas in vitro), como la citrato sintasa o también por medio del cambio del contenido de una sola proteína, como el citocromo c. Esto es válido bajo la mayoría de las condiciones, debido a que los cambios del volumen mitocondrial determinado mediante estimaciones morfométricas van en paralelo junto a los cambios de los valores de velocidad máxima (Vmax) de un marcador enzimático. La medición de la actividad enzimática o de proteínas únicas, ha sido útil para determinar el turnover mitocondrial, asumiendo que le comportamiento de la proteína medida representa el comportamiento del organelo. Este supuesto debe ser considerado debido a que la composición mitocondrial de proteínas puede variar en respuesta a ejercicio crónico, particularmente cuando se combina con una variedad de condiciones como la deficiencia de hierro, inhibición de la síntesis de proteínas o en enfermedades producidas por fallas en mtDNA.
La medición de marcadores proteicos representativos como el citocromo c o la actividad de la citocromo-c oxidasa (COX) ha permitido a los fisiólogos del ejercicio reconocer que, en respuesta a un estímulo constante, se requieren 6 semanas de entrenamiento de endurance para alcanzar un nuevo y estable contendido mitocondrial. La cronología de los cambios depende del tipo de fibra reclutada, así como también depende de la frecuencia, intensidad y duración de las sesiones de ejercicio. Las adaptaciones mitocondriales no ocurren en fibras que no son reclutadas durante la sesión de ejercicio, lo cual concuerda con la idea de que el estimulo para la biogénesis mitocondrial se origina en el músculo contráctil, independiente de influencias humorales. Una aplicación de este hecho es que los programas de entrenamiento de endurance deben ser desarrollados de manera tal que permitan el reclutamiento de unidades motoras rápidas fatigables que contengan fibras tipo IIb (blancas de rápida contracción) si es que se requiere conseguir adaptaciones de biogénesis mitocondrial en ese tipo de fibras. Es interesante señalar que el entrenamiento contra resistencia, que si bien lleva a un reclutamiento de unidades motoras rápidas fatigables, no lleva a una adaptación mitocondrial. Debido a la gran intensidad y baja duración de la mayoría de los programas de entrenamiento contra resistencias, estos representan un fuerte estímulo para la síntesis de proteínas miofibrilares que llevan a la hipertrofia muscular, con lo cual el contendido mitocondrial dentro de una célula muscular hipertrofiada se podría "diluir" (dilución mitocondrial). Esto incrementa la distancia de difusión del oxígeno y sustratos y no representa una adaptación favorable con respecto al rendimiento de endurance.
El tiempo aproximado de 6 semanas requerido para alcanzar un nuevo estado estable en el contenido mitocondrial en respuesta al entrenamiento de endurance claramente no refleja los tempranos eventos moleculares que en definitiva llevarán a cambios morfológicos medibles. De hecho, los cambios en el contenido de proteínas mitocondriales podrían ser visibles cronológicamente más temprano que lo señalado anteriormente. Las proteínas mitocondriales tienen un turn over con una vida media de 1 semana luego de que un nuevo nivel de actividad contráctil muscular es logrado. Esto quiere decir que un estímulo de ejercicio continuo es requerido para mantener el contenido mitocondrial en un nivel elevado luego de un periodo de entrenamiento; de lo contrario se perdería capacidad mitocondrial y rendimiento de endurance. Es interesante notar que el contenido de fosfolípidos ocurre con una vida media aún más corta (4 días) sugiriendo que el ensamblaje y/o degradación del organelo podría ser iniciado por cambios en la composición fosfolipídica. En la ausencia de ritmos normales de síntesis de citocromos e incorporación a la membrana interna durante deficiencia de hierro, la actividad contráctil impuesta parece llevar a una síntesis continuada de lípidos de membrana, provocando un incremento en el volumen mitocondrial, con una reducción marcada en el contenido de proteínas. Esto indica que la síntesis de fosfolípidos y proteínas no están necesariamente actuando en paralelo durante la biogénesis mitocondrial inducida por actividad contráctil muscular. Esta información también sugiere que la proporción lípido/proteína en la mitocondria debe cambiar en cierta medida durante la transición hacia un menor o mayor contenido mitocondrial. Este cambio parece ser sutil como resultado del entrenamiento o estimulación crónica y en la mayoría de los casos parece no afectar el ritmo de consumo de oxígeno por unidad de volumen mitocondrial.
La biogénesis mitocondrial lleva a cambios en el metabolismo celular y rendimiento muscular durante ejercicio de enduranceEl incremento marcado en el rendimiento que resulta a partir de la biogénesis mitocondrial es consecuencia de cambios en el metabolismo muscular durante el ejercicio. Durante contracciones musculares agudas, la concentración de ADP libre (ADPf) se incrementa. Este incremento lleva a la reacción de equilibrio, mediada por creatina fosfoquinasa (CPK), hacia la formación de ATP y creatina (Ver Figura 1). El ADPf también es un sustrato y activador alostérico en la vía glicolítica y controla la respiración mitocondrial activa (estado 3). Debido a que el entrenamiento de endurance incrementa el contenido mitocondrial del músculo esquelético sin mayores efectos sobre CPK o enzimas glicolíticas, sería razonable asumir que una mayor fracción de los requerimientos de energía para un determinado esfuerzo de trabajo podría ser ahora derivado del metabolismo aeróbico. Esto se debería a una mayor sensibilidad de la respiración mitocondrial frente a ADPf, ya que un menor incremento en la concentración del metabolito es requerida para alcanzar el mismo nivel de consumo de oxígeno (Ver Figura 1). Esta reducción del incremento de ADPf atenuará la glicolísis y la formación de ácido láctico y permitirá un ahorro de fosfocreatina. Además, un ritmo menor podrá ser observado con respecto a la formación de AMP. Esto último llevaría a una menor activación de AMPkinasa (AMPK), un factor que podría ser importante para la reducción, inducida por entrenamiento, en la translocación del GLUT-4 desde el pool citosólico hacia la membrana plasmática. Esto, en conjunto con un incremento en la actividad de enzimas mitocondriales involucradas en la
-oxidación, predispone al individuo hacia una mayor oxidación de lípidos durante el ejercicio.
El incrementado contenido mitocondrial inducido por entrenamiento de endurance no solo lleva a una disminución de la producción de lactato, si no que también incrementa la eliminación de este metabolito. Recientemente, una enzima, la lactato dehidrogenasa, fue localizada en el organelo y el transporte de lactato hacia la mitocondria puede ocurrir vía transportador monocarboxilado mitocondrial (MCT1). Un incremento en el contenido mitocondrial como resultado de ejercicio crónico podría incrementar la oxidación de lactato, resultando en un ritmo de liberación menor desde el músculo. Además, a mayor contenido mitocondrial por gramo de músculo, menor es el ritmo de respiración requerido por mitocondrion para cualquier carga de trabajo dada (Ver Figura 1). Esto podría llevar a una reducción en el nivel de especies de oxígeno reactivas (ROS) potencialmente dañinas, incluso frente a ritmos constantes de consumo de oxígeno expresado por gramo de músculo. La combinación de una disminución en la producción de ROS, junto con un incremento en enzimas mitocondriales protectoras de ROS, sustentan la idea de que un beneficio adicional de la actividad muscular contráctil crónica, además del incremento en la capacidad oxidativa, es una reducción en el potencial de las ROS para dañar proteínas, lípidos o ADN. Al contrario, a menor contenido mitocondrial, como es evidente en ciertos tejidos como consecuencia del envejecimiento, mayor es la tendencia de las ROS para inducir daño, sobre todo a nivel de mtDNA. Esto destaca una razón potencialmente importante para mantener el contenido mitocondrial muscular con un programa regular de actividad física durante el proceso de envejecimiento.
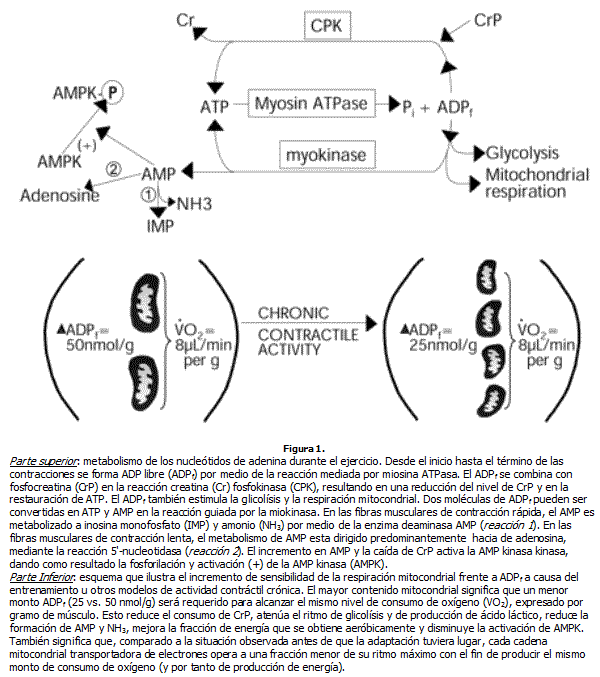
La biogénesis mitocondrial requiere la cooperación del genoma nuclear y del mitocondrialUno de los aspectos más fascinantes de la síntesis mitocondrial es que requiere de la cooperación de los genomas nuclear y mitocondrial (Ver Figura 2). La mitocondria contiene su propio mtDNA codificando varios genes. Si bien el mtDNA solo tiene 16.659 nucleotidos (v/s 3 billones de nucleotidos del DNA nuclear), aparecen 13 ARNm que codifican proteínas esenciales de la cadena respiratoria, responsables del transporte de electrones y síntesis de ATP. Sin embargo, esto representa solo una pequeña fracción del número total de proteínas involucradas en la producción y síntesis de mitocondrias. Las demás proteínas mitocondriales se codifican en el genoma nuclear. Por tanto, la biogénesis mitocondrial requiere la co-expresión del genoma nuclear y del genoma mitocondrial para asegurar un ensamblaje y expresión apropiada del retículo mitocondrial. Holoenzimas multisubunidades, como la COX o la NADH dehidrogenasa, son formadas a partir de la combinación de proteínas codificadas en el genoma nuclear y de proteínas codificadas en el genoma mitocondrial (Ver Figura 2). Debido a que la COX contiene subunidades codificadas por el genoma nuclear y por el genoma mitocondrial, esta enzima es un modelo útil para estudiar la interacción de estos dos genomas. En músculo humano se ha podido observar una mayor coordinación de estos dos genomas durante la biogénesis mitocondrial en sujetos entrenados v/s sujetos no entrenados. Se ha demostrado un incremento en el nivel de ARNm codificando para productos de genes mitocondriales y nucleares a causa de la actividad contráctil crónica desde 1986. Sin embargo, también se han podido observar interrupciones en la coordinación durante tratamientos con hormona tiroidea, sugiriendo que la coordinación de la expresión genética (coordinación que permite una relación estoiquiométrica estricta), no es absolutamente necesaria para la formación de un organelo funcional.
El retículo mitocondrial existe en distintas regiones celulares, donde posee diferentes propiedades bioquímicasHay dos tipos de mitocondrias:
Mitocondrias subsarcolémicas: ubicadas en proximidad al sarcolema, constituyen el 10-15% del total de volumen mitocondrial celular y contribuyen con ATP principalmente para el funcionamiento de la membrana. Se adaptan casi siempre en forma más rápida a las variaciones en el uso muscular (sea un incremento o disminución de su uso).
Mitocondrias intermiofibrilares: se localizan entre las miofibrillas y contienen un ritmo respiratorio y actividad enzimática superior y suministran ATP a las miofibrillas contráctiles. Tienen un ritmo superior de importación de proteínas precursoras, pero un menor nivel del fosfolípido cardiolipin.
Las causas de las diferencias entre los subtipos de mitocondrias no están claras, pero podrían deberse a diferencias en las demandas de ATP que se dan en cada región subcelular.
La presencia de poblaciones mitocondriales heterogéneas puede tener un profundo impacto en los gradientes de difusión de la célula. Se ha hipotetizado que un incremento preferencial en la población de mitocondrias subsarcolémicas en respuesta al entrenamiento podría incrementar la habilidad de la célula para tomar y metabolizar lípidos.
Mecanismos celulares de la biogenesis mitocondrialLa contracción muscular inicia una serie de eventos moleculares, bioquímicos y fisiológicos que llevan a la biogénesis mitocondrial (Ver Figura 3). En respuesta a estímulos como la actividad contráctil, varias kinasas o fosfatasas son activadas en la célula y esto produce múltiples eventos de transducción de señales. La magnitud de la señal o señales, hasta cierto punto, se relaciona con la intensidad y duración del esfuerzo contráctil. Estas señales inducen cambios (incremento o disminución) en la expresión de genes nucleares codificando proteínas mitocondriales. Estos genes luego se transcriben en el núcleo y el ARNm se traduce en los ribosomas (en el citoplasma). Las proteínas destinadas para la mitocondria son escoltadas al compartimiento mitocondrial mediante la maquinaria de importación de proteínas. Una vez adentro de la matriz mitocondrial, el factor de transcripción de la mitocondria es dirigido hacia el genoma mitocondrial, donde juega un rol clave en la regulación de la transcripción y replicación del ARNm para la biogénesis mitocondrial.
Eventos señaladores inicialesAl momento de la contracción muscular ocurren rápidos eventos, que podrían formar parte del proceso de señalización inicial que llevaría hacia la síntesis de lípidos y proteínas. Estos cambios incluyen 1) cambios en la conformación de proteínas sensitivas al voltaje, que responden a los potenciales de acción sarcolémicos, 2) activación de moléculas integrin en la superficie celular (mecanotransductores), 3) flujo de iones (como el Ca2+) en la célula muscular contráctil, 4) ciclaje de puentes cruzados y desarrollo de tensión y 5) turnover de ATP y el consiguiente estímulo sobre el metabolismo. Con respecto a la biogénesis mitocondrial, la discusión se restringirá a los eventos para los cuales existe evidencia (señalización por calcio y turnover de ATP).
Calcio. Una vez liberado desde el retículo sarcoplasmático, el calcio permite la interacción de la actina con la miosina en las células musculares. También está bien reconocido como un importante segundo mensajero en una variedad de tipos de células, incluyendo al músculo. Un incremento en la concentración de calcio podría activar a una serie de kinasas, como por ejemplo la calcio/calmodulina kinasa II, o proteína kinasa C (PKC) y también podría activar a fosfatasas, como la calcioneurina, las cuales en ultima instancia translocan su señal hacia le núcleo para alterar el ritmo de transcripción genética (Ver Figura 2). Debido a las tremendas fluctuaciones en los niveles de calcio citosólico durante la contracción y relajación en músculo esquelético y cardiaco, se ha prestado atención al rol del calcio en mediar las adaptaciones musculares. Recientemente se ha descubierto que una modificación artificial de calcio en los músculos puede alterar en forma reversible la expresión de las isoformas de miosina hacia un fenotipo lento, acompañándose este cambio con un incremento en la actividad enzimática mitocondrial. Subsecuente a esto, se ha demostrado que las diferencias entre tipos de fibras, con respecto a los niveles de calcio alcanzados durante el reclutamiento normal de unidades motoras, lleva a una activación diferenciada de calcioneurina. Una vez activada, la calcioneurina parece jugar un rol importante en la determinación fenotípica del tipo de fibras musculares, pero su participación en la regulación de la actividad de genes involucrados en la biogénesis mitocondrial aún no se ha investigado. Sin embargo, es claro que otros eventos que responden al calcio tienen un impacto sobre la actividad mitocondrial y la expresión genética. Primero, un incremento de calcio citosólico esta ligado con el organelo mitocondrial e influye directamente sobre la respiración mitocondrial. Esto ocurriría mediante la activación de dehidrogenasas, las cuales requieren del calcio para estar completamente activas. El cambio del nivel de calcio lleva a un incremento de los niveles de ATP, tanto en el citosol como en la mitocondria (efecto que persiste a pesar de la posterior disminución de los niveles de calcio). Segundo, se han reportado cambios en algunos eventos de fosforilación en la membrana mitocondrial interna, mediados por calcio. Esto ocurriría dentro del rango fisiológico de concentración de calcio y parece estar mediado por la fosforilación de la sub unidad c de la F0F1-ATPasa. Si bien el significado de estos dos hallazgos con respecto a la biogénesis mitocondrial no está establecido, estos podrían formar parte de una cascada de eventos de señalización mitocondrial. Tercero, una disminución en la concentración de calcio dentro del medio que rodeaba células en cultura resultó en un cambio paralelo en la actividad enzimática mitocondrial. Cuarto, se ha podido observar un incremento mediado por calcio en la expresión (niveles de RNAm y actividad de transcripción) de citocromo-c, un importante componente de la cadena transportadora de electrones. Este incremento de transcripción parece estar mediado por activación de isoformas de PKC sensibles al calcio y en parte parece removerse el efecto al inhibir la vía de la proteína kinasa activada por mitógeno (MAPkinasa). Parece ser que la calcio/calmodulina kinasa II o IV no media en esta respuesta. Esta información implica a la PKC y a la MAP kinasa como señales en la expresión del citocromo-c muscular. Finalmente, estudios con células en donde se indujo experimentalmente una depleción del mtDNA ha servido para sustentar la conclusión de que algunos eventos musculares, mediados por calcio, son propagados como resultado directo de un imbalance en la demanda y suministro de energía. En la depleción de mtDNA, la síntesis de ATP está reducida debido a un defecto en la cadena respiratoria, que resulta de un inadecuado nivel de productos genéticos mitocondriales. Esto lleva a un incremento de la concentración de calcio citosólico, presumiblemente debido a que un proceso dependiente de energía, que se encarga de la exportación e importación de calcio, no está funcionando adecuadamente. Con esto se ha observado un incremento de proteínas relacionadas con la liberación de calcio y la respuesta a este (calcioneurina, receptor-1 de rianodina, NFATc), así como también se ha visto un incremento en la expresión de genes nucleares que codifican proteínas mitocondriales, como la subunidad Vb de COX. La interpretación de estos datos es que un imbalance entre la demanda de ATP celular y el suministro de ATP mitocondrial, que lleva a una alteración de la homeostasis del calcio, puede gatillar la inducción de vías de transducción de señales, que llevarían a la fosforilación o defosforilación de factores de transcripción o estabilización. Por lo que esto podría ser un indicativo de los eventos de señales que tienen lugar durante la actividad contráctil. Sin embargo, un incremento en la concentración de calcio no podría, por si solo, llevar a un aumento general de la biogénesis mitocondrial. Por ejemplo, si bien varias proteínas mitocondriales (malato dehidrogenasa (MDH), la subunidad-
de la F0F1-ATPasa) se incrementan junto con citocromo-c, otras no lo hacen. Por ejemplo, el ARNm codificando para las subunidades IV, Vb y VIc de la COX no se modifica, y los que codifican para la glutamato dehidrogenasa y subunidades II y III de la COX disminuyen. Por lo tanto, el calcio solo forma parte de una amplia serie de señales positivas y negativas que median cambios en la síntesis de componentes mitocondriales.
Turnover de ATP. Durante al menos 25 años se ha hipotetizado que un disturbio en el metabolismo energético, que lleva a una depleción de ATP, a una alteración en el contenido energético de la célula o a un cambio en el potencial de fosforilación, podría iniciar una respuesta compensatoria, que en definitiva llevaría a un incremento del contenido mitocondrial. Sin embargo, un entrenamiento de moderada intensidad puede llevar a la biogénesis mitocondrial en la ausencia de cambios marcados en el nivel de ATP celular. Por tanto, si bien una depleción de ATP puede llevar a un incremento del contenido mitocondrial, basta con el incremento del ritmo de ATP turnover (incremento del ritmo de síntesis y degradación de ATP) para inducir biogénesis mitocondrial. Evidencia experimental sustenta estas ideas. Primero, la depleción de ATP y PC (mediante la droga ácido
-guanidinoproprionico) lleva a un incremento en la actividad enzimática mitocondrial y a un incremento muscular del RNAm del citocromo c. Segundo, como resultado de un acelerado turnover de ATP, el ejercicio incrementa el nivel de AMP y disminuye el nivel de fosfocreatina en el músculo, resultando en la activación de la
2-AMPK (Ver Figura 1). Esta activación puede ser estimulada mediante la administración de cierta droga. Luego de 4 semanas de tratamiento se ha podido observar el incremento de ciertas enzimas mitocondriales (citrato sintasa, succinato dehidrogenasa, citocromo c), pero no de todas (carnitina palmitoiltransfersa (CPT), hidroxi-acil-CoA dehidrogenasa). Esto sugiere que la AMPK esta involucrada parcialmente en señalar la adaptación mitocondrial frente a la actividad contráctil. Tercero, recientes estudios sustentan la hipótesis del desacoplamiento mitocondrial. El desacoplamiento se refiere a la disipación de la gradiente electroquímica a través de la membrana mitocondrial interna, lo cual disminuye l potencial para la producción de ATP al entorpecer la actividad de la F0F1-ATPasa. Subsecuente a esto, el transporte de electrones y el consumo de oxígeno es acelerado debido a que el control que ejerce el ADP se pierde y la utilización de ATP excede a la síntesis. En este respecto, la condición es análoga al ejercicio intenso. El desacoplamiento puede ser logrado con drogas in vitro, o por la sobre expresión de proteínas desacoplantes (UCP). Luego de 6 horas post desacoplamiento se observó una inducción del factor de transcripción NRF-1 (factor-1 de respiración nuclear). El NRF-1 ha sido ampliamente involucrado en la activación transcripcional de múltiples genes involucrados en la biogénesis mitocondrial. Subsecuente a la inducción de NRF-1 y la activación de genes específicos, se ha podido observar un incremento de la sintasa de ácido
-aminolevulínico (ALAs), la enzima que limita ritmo-limitante en la síntesis de heme. Como parte de todos los citocromos mitocondriales, el heme es un componente vital en la cadena respiratoria. Por tanto, parece que un incremento en la respiración mitocondrial, o un déficit entre la demanda celular de ATP y el suministro mitocondrial de este, provee un estímulo para una inducción de una variedad de genes involucrados en la biogénesis del organelo mitocondrial.
En resumen, existe evidencia que sugiere que la señal del calcio y los disturbios del turnover de ATP (actuando interactiva y complementariamente) pueden llevar a la biogénesis mitocondrial.
Eventos de fosforilaciónEl ejercicio puede activar a varias kinasas responsables de fosforilar factores de transcripción. Esta activación es independiente de factores humorales. La actividad contráctil aeróbica puede activar a kinasas como: PKC, kinasa regulada por señal extracelular (ERK)-1 y ERK2 MAP kinasas, p38kinasa, kinasa S6 ribosómica p90, kinasa con terminal NH2 c-Jun, AMPK, kinasa factor de respuesta sérica independiente de calcio, Raf-1, kinasa 2 activada por MAP kinasa (MAPKAP kinasa-2) y kinasa 1 activada por mitogeno y estrés (MSK1). Estos resultados han sido demostrados en modelos de actividad contráctil de humanos y roedores. La información indica que el ejercicio tiene un potencial vasto para alterar las vías de señalización por kinasas y la posterior fosforilación de factores de transcripción o, alternativamente, los factores de estabilización del ARNm.
Transcripción de genes nuclearesEn general la transcripción es regulada por proteínas llamadas factores de transcripción, que regulan la expresión de ciertos genes. Varios de estos factores de transcripción han sido involucrados en la biogénesis mitocondrial (NRF-1, NRF-2, receptores-
y
activados por peroxisoma proliferador (PPAR-
y PPAR-
), Egr-1 (zif286), c-Jun, c-Fos y Sp1. La actividad contráctil induce incrementos en los niveles de varios de estos, consistente con el hecho de los cambios fibrilares fenotípicos inducidos por el ejercicio. Los genes nucleares que codifican proteínas mitocondriales poseen elementos que responden a estos factores de trascripción, que al unirse inducen la activación de la trascripción. Al parecer no es absolutamente necesaria una coordinación del incremento de las proteínas codificadas en el núcleo para el incremento de la función fisiológica mitocondrial, aunque esto induce un cambio fenotípico del organelo mitocondrial. Esto sugiere que el ejercicio puede inducir la activación diferenciada de unos y otros factores de transcripción, que si bien pueden no actuar en forma coordinada, esto no afecta al incremento de funcionalidad mitocondrial.
Estabilidad del ARNmLos niveles celulares de ARNm son un producto del ritmo de producción (transcripción genética) y del ritmo de degradación (estabilidad del ARNm). La estabilidad del ARNm está usualmente mediada por factores proteicos que permiten estabilizar o desestabilizar el ARNm. Estos se expresan de una manera específica en cada tejido, llevando a una amplia variación de la estabilidad del ARNm entre los diversos tipos de tejido. En general, la estabilidad de la transcripción nuclear que codifica proteínas mitocondriales parece ser menos estable en el hígado y más estable en el músculo esquelético. Por ejemplo, el ARNm de ALAs posee una vida media muy corta en el hígado (22 minutos) pero tiene una vida media de 14 horas en el músculo esquelético. Por tanto la estabilización del ARNm tendría su mayor impacto sobre la biogénesis mitocondrial hepática, ya que un modesto incremento de la estabilidad del ARNm en este tejido tendría un gran impacto sobre el nivel de ARNm. Con respecto a esto, la estabilización del ARNm ha mostrado jugar un rol importante en la expresión de la subunidad beta de la F1-ATPasa hepática durante etapas neonatales. Los cambios en la estabilidad del ARNm y su efecto sobre la biogénesis mitocondrial durante el desarrollo celular muscular no se conoce.
En células en cultura, la vida media del ARNm que transcribe para proteínas mitocondriales tiene un rango de 10 a 28 horas. Es interesante señalar que una inhibición de la síntesis de proteínas mitocondriales llevó a un incremento de la estabilidad del ARNm nuclear, que en promedio fue del 700%. No se observó un incremento en la estabilidad del ARNm mitocondrial. Esto sugeriría que una reducción en la síntesis de proteínas mitocondriales, lo cual interrumpe el ensamblaje de la cadena respiratoria, podría llevar a un incremento en la actividad de las proteínas que unen ARN y protegen a estos de la degradación, llevando a un incremento del nivel de ARNm. Esto también se puede observar en células con problemas respiratorios inducidos experimentalmente por depleción de mtDNA, en donde se puede observar un incremento del ARNm de múltiples genes nucleares con productos localizados en la mitocondria.
Pacientes con mutaciones del mtDNA exhiben un gran incremento compensatorio en los niveles de ARNm derivado del genoma nuclear. El factor común en estas diversas condiciones es, probablemente, el reducido estado energético de la célula o posiblemente un incremento en ROS, el cual es producido cuando la cadena transportadora de electrones es inhibida. La información sugiere que una modificación desventajosa en la estructura de la cadena transportadora, llevando a una reducida función (disminución del suministro de ATP) con respecto a la normal, representa una señal para el incremento de los productos codificados en el genoma nuclear. Este incremento, usualmente medido mediante niveles de ARNm, podría ser en gran parte el producto de un incremento de la estabilidad del ARNm. Esta información llevaría a sustentar la idea de que una señal derivada del metabolismo, relacionada con el turnover de ATP está involucrada en mediar la biogénesis mitocondrial. Es también importante destacar que las proteínas unidoras de ARN que confieren estabilidad o inestabilidad permanecen incógnitas en la mayoría de los tejidos y menos aun se conoce sobre la estabilidad del ARNm del músculo esquelético o el rol de la actividad contráctil en la modificación de este proceso.
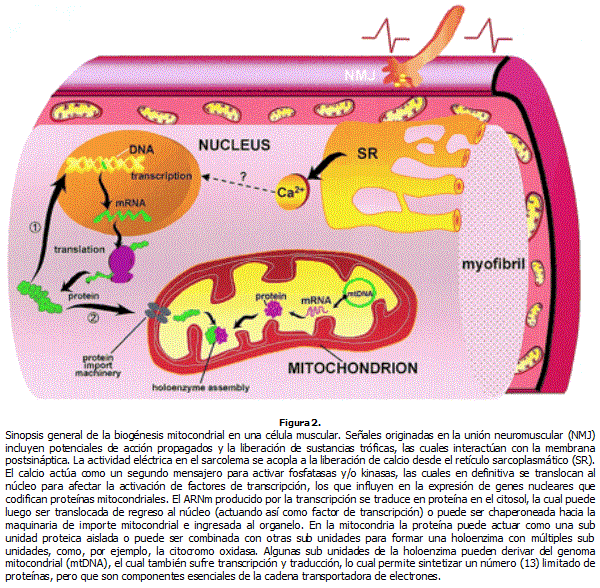
Ejemplo de un gen nuclear codificando una proteína mitocondrial: Citocromo cEl citocromo c ha sido usado por muchos años como indicador representativo del contenido mitocondrial muscular. Su expresión es influenciada por variaciones del desuso muscular, así como también por la intensidad y duración del ejercicio. El estado tiroideo regula su concentración. Para entender mejor la regulación de la expresión del citocromo c, resultante de la actividad contráctil, se empleó estimulación eléctrica en miocitos cardiacos neonatales. A los 15-180 minutos post estimulación se observó un incremento en el ARNm de c-Fos y c-Jun y entre 1-12 horas post estimulación se observó un incremento del ARNm de NRF-1. Estos cambios precedieron al incremento de ARNm de citocromo c observado 48 horas post estimulación. Activación transcripcional del citocromo c pudo ser observada a las 12 horas post estimulación. Esta activación se redujo cuando se mutaron los sitios de unión para NRF-1 y para los elementos respondedores a AMPc (CRE). Otros indicadores de transcripción también vieron disminuida su respuesta cuando se mutó el sitio de unión para Sp1. Esta información confirma la importancia de c-Jun, NRF-1 y Sp1 en la activación transcripcional del citocromo c, al menos en las células cardíacas (Ver Figura 3). Al utilizar células musculares de cultivo se pudo observar que post actividad contráctil estimulada, se incrementó la transcripción de citocromo c y que esto es acompañado de un incremento en el nivel proteico de Sp1 y de un incremento en su unión al DNA luego de 4 días. La expresión del citocromo c se ha visto incrementar mediante una mayor estabilidad de su ARNm y que este sería el evento inicial involucrado en su mayor expresión. Ciertos modelos experimentales corroboran esto último, indicando que el incremento de ARNm observado post periodo de estimulación eléctrica se debería inicialmente (2-4 días post estimulación) a un incremento en la estabilidad del ARNm y que luego seguiría una fase de mayor activación transcripcional (día 5 post estimulación). Este incremento inicial de estabilidad se pudo observar cuando una proteína desestabilizante (no identificada) se unía menos al ARNm del citocromo c, luego de un periodo de 9-13 días de estimulación eléctrica crónica. Esto sugiere que la actividad contráctil lleva a inducir un factor inhibitorio responsable de disminuir la interacción entre una proteína desestabilizante y el ARNm del citocromo c, permitiendo así su incremento. Esta información enfatiza la importancia de reconocer la estabilidad del ARNm como un importante contribuidor de los cambios en la expresión genética que resulta de la actividad contráctil muscular.
Importe de proteínas mitocondrialesNo se puede negar la importancia del genoma mitocondrial con respecto a su contribución de proteínas para la cadena respiratoria mitocondrial, pero también es cierto que la mayor parte de las proteínas mitocondriales son derivadas del ADN nuclear. Por tanto, un mecanismo debe existir para llevar a estas proteínas hacia compartimientos mitocondriales específicos, luego de haber sido sintetizadas en el citosol. La mayoría de las proteínas son fabricadas como "precursoras" con una señal de secuencia, generalmente localizada en el terminal NH2 o como una secuencia interna (Ver Figura 4). Si bien las vías para el importe de proteínas hacia la membrana mitocondrial externa, membrana interna, matriz mitocondrial o espacio intermembrana difieren de algún modo entre sí, la vía más estudiada es aquella que lleva el importe hacia la matriz. En este caso la señal de secuencia, con terminal nitrogenado cargado positivamente, interactúa con una chaperona molecular citosólica que desdobla la proteína precursora y la dirige hacia el complejo receptor de importe de la membrana externa (complejo Tom). Entre las chaperonas citosólicas están la proteína de choque de calor 70-kDa (HSP70) y el factor de estimulación de importe mitocondrial (MSF). Las proteínas precursoras pueden ser dirigidas hacia uno de dos subcomplejos que presenta la maquinaria Tom. Uno de estos, compuesto por los receptores Tom20 y Tom22, es la ruta preferencial para las proteínas precursoras chaperoneadas por la HSP70. Por otro lado, las proteínas precursoras que interactúan con MSF son, en gran parte, dirigidas hacia el heterodímero Tom70 - Tom37. Luego las proteínas precursoras son transferidas desde los receptores Tom hacia Tom40 y las pequeñas proteínas Tom5, Tom6 y Tom7, forman un canal acuoso a través del cual la proteína precursora puede pasar. La proteína precursora es luego llevada hacia la traslocasa de la membrana interna (Tim), otro complejo proteico que permite el movimiento de la proteína precursora hacia la matriz o hacia la membrana interna. Las proteínas involucradas en la translocación de la proteína precursora hacia la matriz son la Tim17, Tim23 y Tim44. Las proteínas Tim17 y Tim23 actúan como proteínas integrales de membrana, atravesando la membrana mitocondrial interna y, de esta manera, presentando dominios en la matriz y en el espacio intermembrana. En una manera similar al complejo receptor Tom, Tim17 y Tim23 se unen con la proteína precursora, previniendo cualquier doblamiento de esta, que de ocurrir impediría el paso de esta a la matriz. Además, Tim17 y Tim23 forman un poro acuoso a través del cual la proteína precursora puede viajar. Por otro lado, Tim44 es una proteína periférica de la membrana asegurada en la cara interna de la membrana mitocondrial interna. La proteína Tim44 sirve de anclaje para la chaperona de la matriz HSP70 (mtHSP70), la cual actúa de tal manera que jala a la proteína precursora hacia la matriz (Ver Figura 4). Además de estas proteínas, el fosfolípido cardiolipin, de la membrana mitocondrial interna, es imperativo para la translocación de la proteína precursora, pues se encargaría de posicionar a esta de la manera correcta para la interacción con el complejo Tim44-mtHSP70. La importancia de este fosfolípido ha sido demostrada por estudios en donde la función de la cardiolipina ha sido bloqueada mediante la droga Adriamycin, lo cual tuvo como consecuencia una reducción en el importe de proteínas destinadas para la matriz.
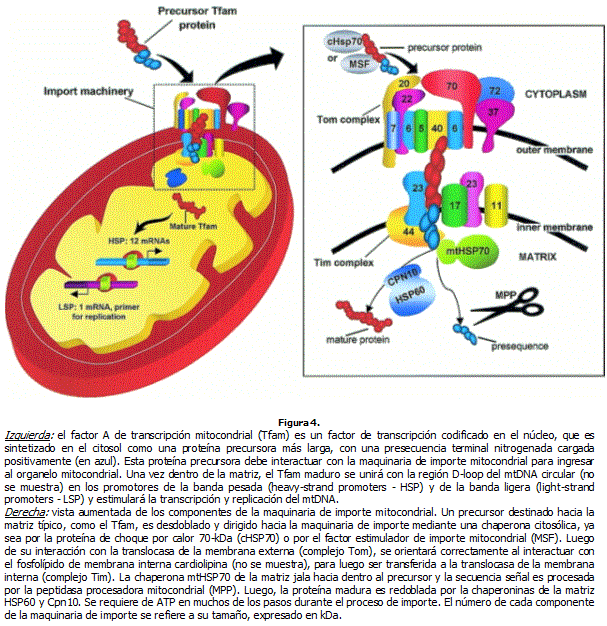
Otros dos elementos son requeridos para el correcto importe de proteínas precursoras hacia la matriz. Estos son 1) la presencia de un potencial a través de la membrana interna (
, negativo al interior) para ayudar a jalar la presecuencia cargada positivamente hacia la matriz y 2) la disponibilidad de ATP tanto en el citosol como en la matriz. Agentes desacoplantes que disipan
reducen el importe de proteínas, mientras que la depleción de ATP previene el desdoblamiento (el desdoblamiento es requerido en el citosol para que la proteína precursora pueda ser dirigida hacia la maquinaria de importe) de la proteína precursora en el citosol y/o la acción de la mtHSP70 en la matriz. Por tanto, reducciones en los niveles de ATP celular como los producidos por la actividad contráctil severa, o defectos en la producción de ATP como la encontrada en células con mutaciones del mtADN, podrían afectar el ritmo de importe hacia la mitocondria.
Luego de su llegada a la matriz, la secuencia señal con terminal nitrogenado es procesada por una proteína mitocondrial, la peptidasa procesadoras mitocondrial (MPP), formando una proteína madura. Luego es redoblada hacia su conformación activa por un sistema de chaperoninas mitocondriales: proteína de choque de calor 60-kDa (HSP6) y chaperonina 10-kDa (Cpn10).
La mayoría del trabajo realizado que define los componentes de la maquinaria de importe mitocondrial, así como sus funciones fisiológicas, no se ha realizado con células de mamíferos, aunque actualmente el trabajo con este tipo de células está en progreso. Por ejemplo, la cinética de las proteínas precursoras de matriz que son importadas hacia fracciones de las mitocondrias sub sarcolémicas e intermiofibrilares, la dependencia de esta cinética en el ATP y en la cardiolipina y su relación con la respiración mitocondrial, se han podido estudiar recientemente. Las mitocondrias intermiofibrilares importan proteínas precursoras más ávidamente que las mitocondrias sub sarcolémicas y existe una relación directa entre la capacidad para la respiración mitocondrial (y por tanto para la producción de ATP) y el ritmo de importe proteico. También se ha observado que un número determinado de componentes proteicos de la maquinaria de importe son inducidos en respuesta a la actividad contráctil crónica. Entre estás encontramos: chaperonas MSF, HSP70 citosólica, mtHSP70, HSP60, Cpn10, así como también al receptor de importe Tom20. Coincidentemente con estos incrementos se puede observar un incremento, inducido por actividad contráctil, en el ritmo de importe hacia la matriz pero no hacia la membrana externa. Este efecto diferenciado sobre el importe de proteínas precursoras hacia diferentes compartimientos mitocondriales provee un ejemplo de cómo la actividad contráctil puede llevar a una alteración en la estoiquiometría proteica mitocondrial. El ritmo acelerado de importe proteico hacia la matriz mitocondrial puede ser reproducido en mitocondria cardiaca obtenida de animales tratados con hormona tiroidea. Por tanto, el efecto no solamente se observa frente a un incremento de actividad contráctil.
Para definir en forma más simple el rol de algunos componentes determinados de la vía de importe, en lo que respecta a la determinación de la cinética de transporte, se han empleado células en cultura para medir el importe. Se midió el importe de MDH hacia la mitocondria. Se observó un incremento de importe durante la biogénesis mitocondrial (coincidente con la diferenciación muscular). La hormona tiroidea aceleró el ritmo de importe e incrementó la expresión de Tom20. Se ha observado que, paralelo a un incremento de la expresión de Tom20, ocurre un incremento en el ritmo de importe, lo cual es magnitud dependiente (a mayor expresión, mayor importe). Por el contrario, una reducción en la expresión de Tom20 llevó a una reducción en el importe de MDH. Estos datos sugieren que el importe de proteínas destinadas a la matriz es controlado, al menos en parte, por la expresión de To20.
La vía de importe de proteínas representa un ejemplo del tráfico intracelular, que es importante para la biogénesis del organelo, y que podría, bajo ciertas circunstancias, determinar el incremento del contenido mitocondrial como resultado de ejercicio crónico. Si este fuera el caso, se debería poder demostrar que es inducible y que opera a un ritmo tal que limita la vía de importe general bajo cierta condición (ejercicio crónico). Si el ritmo de importe fuese lo suficientemente lento como para limitar la biogénesis mitocondrial, entonces un pool de proteínas precursoras en el citosol celular podría ser medido. En la ausencia de tal pool, se asumiría que las proteínas precursoras sintetizadas son rápidamente importadas hacia la mitocondria y por tanto la cinética de la maquinaria de importación no limitaría la síntesis global del organelo. Esto deberá ser testeado en un sistema celular rigurosamente controlado (controlar variables), en donde los destinos de las proteínas precursoras (como por ejemplo su degradación citosólica) pueda ser bloqueado. Es posible que el importe de proteínas pueda limitar bajo ciertas condiciones de actividad contráctil crónica si es que, por ejemplo, la transcripción y/o translación se aceleraran a tal nivel que provocaran una saturación en la abundancia de proteínas precursoras para la maquinaria de importe mitocondrial. A pesar de esto último, la actividad contráctil, y el consiguiente incremento en la actividad de importe mitocondrial, permitiría incrementar la sensibilidad mitocondrial al ingreso de proteínas precursoras, frente a una determinada concentración citosólica de estas. Esto representa una ventaja en situaciones donde los factores degradadores citosólicos de proteínas precursoras sea elevado, pues el incremento de importe provocaría un menor tiempo de interacción entre proteínas precursoras y factores de degradación, lo que favorecería el incremento de masa mitocondrial.
Progreso en el área del importe proteico será posible a medida que se realicen experimentos con homólogos mamíferos del modelo de la maquinaria de importe mitocondrial. Recientemente, la primera enfermedad que se debería únicamente a una mutación en un componente proteico de la maquinaria de importe ha sido identificada. Una mutación en la proteína distonia sordera (DPP) resulta en un desorden neurodegenerativo, caracterizado por distonia muscular, sordera sensoneural y ceguera. La DPP es una proteína mitocondrial que se asemeja a la Tim8p, una proteína del espacio intermembrana involucrada en el proceso de importe. Además, mutaciones en el receptor de importe Tom70 llevarían a desórdenes en el mtADN, pues la Tom70 es clave para el mantenimiento del mtADN. La reciente clonación de Tom22, así como la de miembros de la maquinaria Tim, será de ayuda para dilucidar los roles funcionales de componentes individuales de la maquinaria de importe con respecto al proceso de importe y la relevancia del importe en las enfermedades con base mitocondrial y en la biogénesis del organelo.
Expresión del mtADNEl mtADN contribuye con proteínas que son esenciales para la función de la cadena respiratoria mitocondrial. Mutaciones o deterioros en el mtADN puede resultar en productos genéticos defectuosos o simplemente puede resultar en su ausencia, lo cual repercute negativamente sobre la respiración mitocondrial y sobre las enfermedades mitocondriales, de las cuales un gran número ha podido ser documentado. Estas enfermedades son específicas de cada tipo de tejido, localizándose en órganos con una alta demanda energética, como en el cerebro, corazón y músculo. Como se esperaría, el resultado de una anormalidad del mtADN en el músculo esquelético resulta en la intolerancia al ejercicio, fatiga y una exagerada producción de ácido láctico.
El mtADN se puede replicar en forma independiente del ADN nuclear y se encuentra presente en número elevado de copias (103 - 104 copias) virtualmente en todas las células del cuerpo. La replicación del mtADN requiere de la presencia de la polimerasa-
(Pol-
), de una proteína unidora de una sola tira (SSB). Esta última facilita la actividad de la Pol-
y de la Tfam, lo cual inicia la transcripción, que permitirá la replicación del ADN. También se requiere de una endonucleasa procesadora de ARN mitocondrial (RNasaMRP), la cual procesa al ARNm para que luego se de lugar a la replicación.
Usando el modelo de la estimulación crónica para inducir biogénesis mitocondrial, se ha podido demostrar que las variaciones en el nivel de transcripción mitocondrial se correlaciona muy bien con las variaciones en el mtADN. Esta correlación también se pudo observar al comparar músculos de sujetos entrenados y no entrenados, y cuando se estudió a sujetos que tenían disminuido su mtADN. Esta información sugiere que la replicación del mtADN en múltiples copias (o cambios en su conformación específica) regula el nivel de expresión genética mitocondrial en células musculares esqueléticas. Aunque estudios realizados en otros tipos de tejido, y también en músculo, no concuerdan con esto. Una variedad de condiciones parecen existir en las cuales el número de copias del mtADN no iguala al cambio en el nivel de ARNm o al cambio en la capacidad oxidativa. Se podría argumentar que, debido a que la replicación y la transcripción parecen estar controladas por la acción de la Tfam y debido a que la replicación se sustenta en la formación de ARN, la transcripción podría ser el proceso más importante de los dos. Queda por resolverse si es que el control vía número de copias de mtADN es específico de la biogénesis mitocondrial inducida por la actividad contráctil o si es que las diferencias de resultados podrían ser explicadas por variaciones en los acercamientos experimentales o por los instrumentos de medición empleados. De cualquier manera, un incremento del número de copias del mtADN observado como consecuencia de actividad contráctil crónica se acompaña por un aumento del SSB, del RNasaMRP y del Tfam, pero no se observa un incremento en Pol-
. Esta información sugiere que Pol-
es suficientemente abundante y no limitaría la transcripción del mtADN.
Tfam ha sido extensamente estudiada como el factor de transcripción más importante en los mamíferos. El nivel de Tfam se correlaciona bien con la abundancia de mtADN y con su pérdida, tanto en pacientes con miopatias mitocondriales o producidas por interrupción experimenta del gen Yfam, lo cual resulta en una depleción parcial o total del mtADN. Animales homocigotos con su Tfam noqueada (knock-out) mueren antes del día 10 del periodo embrionario y se caracterizan por presentar mitocondrias anormales y una función empeorada en fosforilación oxidativa. Al parecer el Tfam es clave para la producción de mtADN y mtARN. Animales con anormalidades en Tfam presentan características como las encontradas en el síndrome Kerns-Sayre (enfermedad mitocondrial), donde es evidente una cardiomiopatía dilatada, una función cardíaca anormal y una morfología mitocondrial anormal. Esta información sugiere que Tfam es importante para la función cardíaca normal, probablemente porque le corazón posee el mayor monto de mitocondrias en comparación a cualquier otro tejido. Además, la información demuestra la importancia del desarrollo de modelos experimentales con animales para incrementar nuestro conocimiento sobre la función específica de ciertas proteínas y su rol en las enfermedades con base mitocondrial.
En el músculo esquelético, la expresión y actividad de Tfam es modificada por la actividad contráctil. Durante estimulación crónica (3h/día, durante 1-7 días) se observó un incremento del ARNm de Tfam al cuarto día. Al quinto día se observó un incremento en el importe hacia la mitocondria. Al séptimo día se observó un incremento en el contenido proteico del Tfam mitocondrial y una mayor unión con el ADN. Este último hallazgo se dio en paralelo con un incremento en el ARNm del COX III y de la actividad enzimática COX. Esta información sugiere que la expresión de Tfam se correlaciona bien con las alteraciones de la activación transcripcional mitocondrial y con la capacidad oxidativa. Por tanto, los eventos celulares que limitan la expresión de Tfam podrían también restringir la biogénesis mitocondrial. Debido a que el incremento de ARNm de Tfam fue el primer evento que se pudo notar, es probable que la transcripción del gen Tfam juegue un rol importante. Sin embargo, debido al lento ritmo de importe de Tfam hacia la mitocondria, comparado con el ritmo de importe de otras proteínas hacia la matriz, también parece razonable pensar que un incremento en el ritmo de importe, coincidente con una mayor expresión de Tfam inducida por actividad contráctil, complemente la facilitación del incremento del ritmo global de replicación y transcripción del mtADN.
Un segundo factor de transcripción es ahora reconocido como un importante agente regulador del mtADN. Además de Tfam, una proteína 43-KDa, conocida como p43, se ha visto recientemente que interactúa con hormona tiroidea T3, así como también con el mtADN. Este es un hallazgo importante, pues ayuda a explicar la acción directa de la T3 sobre la transcripción mitocondrial en experimentos in vivo en donde se utilizó mitocondrias aisladas. La p43 ha demostrado inducir diferenciación muscular al incrementar la actividad enzimática mitocondrial y, como resultado, la expresión de la miogenina (factor regulador miogénico). Si la biogénesis mitocondrial, en respuesta a actividad contráctil, en verdad fuese independiente de influencias hormonales (T3), entonces p43 no debería jugar un rol importante en la adaptación observada y, por tanto, el único factor de transcripción de importancia, conocido hasta ahora, sería Tfam. Sería interesante poder determinar si p43 posee algún tipo de influencia independiente de ligando (independiente de T3) o si ejerce un efecto aditivo con Tfam en la determinación de la expresión de mtADN en células musculares.
Síntesis de Proteínas MitocondrialesAdemás de poseer un genoma separado, la mitocondria también posee su propia maquinaria de traducción. Desafortunadamente, poco se conoce sobre la regulación fisiológica de la síntesis de proteínas mitocondriales en músculo esquelético y cardíaco, excepto por algunos pocos estudios efectuados. En mediciones in vitro, se observó que las mitocondrias intermiofibrilares presentan un ritmo de síntesis de proteínas mitocondriales superior al de las mitocondrias subsarcolémicas, lo cual concuerda con el hecho de que las primeras poseen una mayor capacidad oxidativa. La actividad contráctil aguda (5 minutos de estimulación, a 10 Hz) redujo el ritmo de síntesis proteica en las mitocondrias subsarcolémicas, pero a los 55 minutos post estimulación (periodo de recuperación) el ritmo de síntesis volvió a nivel reposo. La degradación proteica no se vio afectada por la estimulación, pero se redujo post estimulación (periodo de recuperación). Esta información sugiere que el ritmo de la síntesis y degradación de proteínas intramitocondriales puede ser influido por actividad contráctil de una manera tiempo-dependiente. Para lograr una respuesta adaptativa muscular frente a estimulación contráctil crónica se requiere de un sistema de traducción mitocondrial intacto. Evidencia de esto nace en experimentos con animales, en donde se empleó cloramfenicol, un inhibir de la síntesis de proteínas mitocondriales, durante estimulación contráctil crónica. Se observó una reducida respuesta adaptativa en la actividad COX, pero la citrato sintasa no se vio afectada. Seguramente esto se debe a que la COX presenta tres subunidades esenciales derivadas del mtADN, que requiere de traducción en el organelo, mientras que la citrato sintasa es completamente derivada desde le genoma nuclear. Dado este requerimiento de síntesis proteica para una adaptación muscular normal al ejercicio, pareciera ser obvio que la síntesis proteica responde al ejercicio crónico. Sorprendentemente, se pudo observar una reducción en la síntesis proteica (día 14 post estimulación, 3h/día) de mitocondrias intermiofibrilares en músculo tibial anterior de rata, mientras que la degradación proteica no se vio afectada. Esta información sustenta la posibilidad de que cualquier cambio en el turnover de proteínas que ocurriese como resultado del ejercicio, sucedería en los primeros momentos desde el inicio del proceso de adaptación, después de lo cual este proceso de síntesis proteica parecería no limitar la biogénesis mitocondrial en respuesta a la actividad contráctil.
RecuperaciónSe ha sospechado desde hace tiempo que la respuesta adaptativa, frente a la actividad contráctil de tipo crónica, se manifiesta predominantemente durante la fase de recuperación, post periodo de ejercicio. Con respecto a la biogénesis mitocondrial, se ha observado que ALAs, la enzima que limita el rimo del metabolismo hem, se incrementa varias horas luego de terminar la sesión de ejercicio. Esta es una observación importante, ya que esta enzima está involucrada en la determinación del contenido funcional de los citocromos mitocondriales encontrados en la cadena respiratoria. Resultados similares se encontraron en células cardíacas post ejercicio. Luego de estimulación aguda (1 sesión de 3 horas) o crónica (7 días, 3 horas/día), se midieron las actividades de ALAs y COX, junto con los niveles de ARNm de ALAs, durante 18-48 horas de recuperación post ejercicio. Se observó que ALAs se incrementó en el periodo de recuperación, pero solo si la estimulación era de tipo crónica. El peak de incremento en actividad ALAs se observó 18 horas después del inicio del periodo de recuperación y este incremento de actividad fue acompañado por un incremento del nivel de ARNm. La actividad COX también se incrementó progresivamente durante el periodo de recuperación en fibras musculares blancas con baja capacidad de oxidación. Varios estudios han demostrado incrementos de la respuesta adaptativa frente a varias formas de actividad contráctil, incrementos que son evidentes durante la fase de recuperación. Entre los incrementos se encuentra un incremento de la síntesis y degradación de proteínas musculares, incremento de la actividad de la kinasa S6 70-kDa, cambios de AMPc (cambio dependiente del tipo de fibra), incremento de ARNm GLUT-4, glicogenia, c-Fos, c-Jun, NRF-1, HSP70 citosólica,
B-cristallin, mioglobina y citrato sintasa, entre otras. Un incremento de la transcripción genética parece ir de la mano con los incrementos recién señalados en enzimas metabólicas o proteínas. La información sugiere que las adaptaciones finales, frente a varios tipos de actividad contráctil, son el resultado de una acumulación de respuestas adaptativas que se originan con la primera sesión de ejercicio, pero que no se manifiestan hasta dentro de cierto tiempo, durante el periodo de recuperación post ejercicio, cuando el músculo permanece en reposo. Además, sugiere que el periodo de recuperación es un componente importante de la fase adaptativa de los genes, necesaria para la proliferación mitocondrial en el músculo.
Conclusiones y futuras direccionesLa actividad contráctil inicia una serie de eventos fisiológicos y bioquímicos que llevan a la biogénesis mitocondrial. En la figura 5 se pueden observar estos eventos. La figura es una ilustración que pretende destacar, brevemente, el trabajo realizado recientemente, describiendo, en forma aproximada, el curso temporal de los cambios involucrados en la biogénesis mitocondrial. Además, la figura pretende servir como modelo de trabajo para ir expandiéndose a medida que nuestro conocimiento gana en detalle. Nótese que las alteraciones del fenotipo muscular resultantes llevan a una adaptación metabólica, que reduce la señal estresora impuesta por una ronda de ejercicio agudo de la misma intensidad y duración, actuando en forma de retroalimentación negativa. Por lo tanto, la señal que antes inducía biogénesis mitocondrial, ahora presumiblemente tenga un efecto (magnitud) menor, luego de que la adaptación a tenido lugar.

El interés en la función mitocondrial, biogénesis y expresión genética en el músculo y en células no musculares, nunca había sido tan elevado. Esto se debe a que la mitocondria provee un modelo de adaptación excelente para el estudio de la biogénesis de organelos en células de mamífero. También se debería a que actualmente se sabe que la mitocondria esta implicada en una amplia variedad de enfermedades. Algunas avenidas de futura investigación, que serán probablemente bien recompensadas, incluyen las siguientes:
Entender la relación entre capacidad para fosforilación oxidativa, la formación de ROS, sus efectos sobre las mutaciones de mtADN y sus consecuencias. Este tipo de trabajo tendría implicancias para el mejoramiento del entendimiento sobre el decaimiento de la capacidad oxidativa en músculos envejecidos. También permitiría profundizar en los efectos del ejercicio físico regular y su potencial para mantener la capacidad oxidativa muscular por sobre el nivel umbral que tiene cada músculo en forma específica, umbral bajo el cual se observan daños en mtADN y la función del órgano disminuye (miopatia mitocondrial).
Evaluar el rol de la actividad contráctil en la modificación del proceso de apoptosis. Ahora se ha establecido que la mitocondria posee un rol importante en gatillar algunas formas de muerte celular programada (apoptosis) en respuesta al estrés. Un cierto numero de proteínas pro apoptoticas (Bax, citocromo c, factor de inducción de apoptosis) y anti apoptoticas (Bcl-2) reciden en el organelo. Vale la pena investigar la función y expresión de estas proteínas en células musculares. Uno de los retos mas fascinantes para aquellos interesados en la biogénesis mitocondrial será determinar los roles positivos y negativos que juega el ejercicio físico regular en la modificación de la opoptosis.
Estudiar la interacción de importantes participantes (Tfam, PGC-1, AMPK, NRF-1) involucrados en la biogénesis mitocondrial, durante un transcurso de tiempo cuidadosamente planeado, en donde se aplique actividad contráctil, seguido por un periodo de recuperación, poniendo especial atención en las etapas iniciales de la biogénesis del organelo. Además, se requiere expandir de nuestro conocimiento con respecto a los efectos de la actividad contráctil sobre la transcripción, la estabilidad del ARNm o la modificación de las proteínas post traducción, aparte del citocromo c.
 |
|
|---|---|
|
revista
digital · Año 12
· N° 112 | Buenos Aires,
Septiembre 2007 |
|